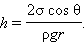Основные Положения Молекулярно-Кинетической Теории (Опытное Обоснование)
Основные Положения Молекулярно-Кинетической Теории (Опытное Обоснование)
В основе молекулярно-кинетической теориистроения вещества лежат три положения:
1. Все тела состоят из частиц (атомов, молекул, ионов и др.);
2. Частицы непрерывно хаотически движутся;
3. Частицы взаимодействуют друг с другом.
Первое положение подтверждают испарение жидкостей и твердых тел, получение фотографий отдельных крупных молекул и групп атомов, косвенные измерения масс и размеров молекул.
Второе положение МКТ о непрерывном движении частиц подтверждают такие явления, как броуновское движение и диффузия.
Броуновское движение - беспорядочное движение малых частиц в жидкости или газе, происходящее под действием молекул окружающей среды.
Подтверждением третьего положения МКТ о взаимодействии частиц является возникновение упругих сил при деформациях тел, существование различных агрегатных состояний (твердого, жидкого, газообразного) одного и того же вещества.
Силы молекулярного взаимодействия зависят от расстояния между молекулами. При этом характер зависимости от расстояния у сил притяжения и сил отталкивания различен. При увеличении расстояния между молекулами силы отталкивания убывают быстрее, чем силы притяжения, а при уменьшении этого расстояния возрастают быстрее, чем силы притяжения.
Билет 8
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Давление газа - результат ударов его молекул о стенки сосуда.
давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.
Билет 9
Температура — физическая величина, характеризующая тепловое состояние тел.
Температура является важным параметром, определяющим не только протекание технологического процесса, но и свойства вещества. Для измерения температуры в системе единиц СИ принята температурная шкала с единицей температуры Кельвин (К). Начальной точкой этой шкалы является абсолютный нуль (0 К).
Для технологических измерений часто применяют температурную шкалу с единицей температуры градус Цельсия (°С),
Для измерения температуры используют различные первичные преобразователи, отличающиеся способом преобразования температуры в промежуточный сигнал. В промышленности наибольшее применение получили следующие первичные преобразователи: термометры расширения, манометрические термометры, термометры сопротивления, термопары (термоэлектрические пирометры) и пирометры излучения. Все они, за исключением пирометров излучения, в процессе эксплуатации находятся в контакте с измеряемой средой
Абсолю́тный нуль температу́ры (реже — абсолютный ноль температуры) — минимальный предел температуры, которую может иметь физическое тело. Абсолютный нуль служит началом отсчёта абсолютной температурной шкалы, например, шкалы Кельвина. В 1954 X Генеральная конференция по мерам и весам установила термодинамическую температурную шкалу с одной реперной точкой — тройной точкой воды, температура которой принята 273,16 К (точно), что соответствует 0,01 °C, так что по шкале Цельсия абсолютному нулю соответствует температура −273,15 °C
отличаются на 273 градуса..т.е. 0 К это 273С
Билет10
Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона ) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
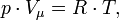
где
- p — давление,
- Vμ — молярный объём,
- T — абсолютная температура,
- R — универсальная газовая постоянная.
Билет 11
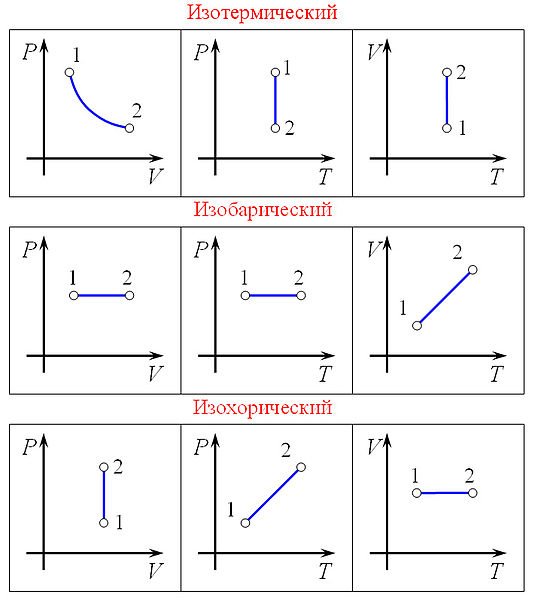
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабата соответственно.
Билет 12
Внутренняя энергия — это энергия движения и взаимодействия частиц, из которых состоит тело.
Внутренняя энергия зависит от температуры тела, его агрегатного состояния, от химических, атомных и ядерных реакций. Она не зависит ни от механического движения тела, ни от положения этого тела относительно других тел.
Внутреннюю энергию можно изменить путем совершения работы и теплопередачи. Если над телом совершается работа, то внутренняя энергия тела увеличивается; если же это тело совершает работу, то его внутренняя энергия уменьшается.
т.е. чтобы изменить внутреннюю энергию тела, нужно изменить его температуру.
Увеличение внутренней энергии можно понаблюдать на интересном опыте «Воздушное огниво». В прозрачный цилиндр с толстыми стенками из оргстекла помещают маленький кусочек ваты. Вдвигают в цилиндр поршень и резким движением опускают его вниз. За счёт совершенной работы внутренняя энергия воздуха при сжатии возрастает, увеличивается его температура, в результате чего вата воспламеняется
Билет 13
Теплопередача — физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к более холодному, что является следствием второго закона термодинамики
Процесс передачи энергии от первого тела ко второму без совершения работы называется теплообменом или по другому теплопередачей. Величина энергии, переданной телу в результате теплообмена, называется количеством теплоты. Если же процесс теплопередачи идет без совершения работы (А = 0), тогда на основании первого закона термодинамики количество теплоты Q равно изменению внутренней энергии тела deltaU. Поэтому, необходимое для нагревания тела на deltaT величина энергии, может быть определено по формуле для количества теплоты:
Q = deltaU = C*deltaT = cm*deltaT,
где m — масса тела, С — теплоемкость тела, с — удельная теплоемкость вещества. Единица удельной теплоемкости — 1 (Дж/(кг • К)). Удельная теплоемкость показывает, какое количество теплоты необходимо для нагрева 1 кг вещества на 1 К. В зависимости от температуры и давления одно и то же вещество может находиться в каком-либо основном агрегатном состоянии: твердом, жидком или газообразном. Общим для всех состояний вещества является хаотический характер движения частиц, составляющих вещество — молекул, атомов или ионов. Расстояния между частицами вещества в газах во много раз превышают размеры самих частиц. Большую часть времени частицы свободно движутся и лишь сравнительно редко испытывают соударения друг с другом. Этим объясняются такие свойства газов, как способность к сжатию, возможность занимать весь предоставленный ему объем. Силы притяжения между частицами газа малы и не способны удержать их друг возле друга.
Q1 + Q2 + Q3 + .+Qn = 0
Билет 14
В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Но скорости молекул тела меняются! Поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется - поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Билет 15
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (V=const). Диаграмма этого процесса(изохора)в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
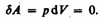
Как уже указывалось в § 53, из первого начала термодинамики (dQ=dU+dA)дляизохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
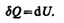
Согласно формуле (53.4),
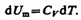
Тогда для произвольной массы газа получим
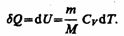 (54.1)
(54.1)

Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа (см. (52.2)) при увеличения объема от V1 до V2 равна
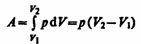 (54.2)
(54.2)
и определяется площадью заштрихованного прямоугольника (рис. 82). Если использовать уравнение (42.5) Клапейрона — Менделеева для выбранных нами двух состояний, то
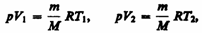
откуда
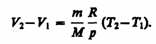
Тогда выражение (54.2) для работы изобарного расширения примет вид
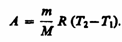 (54.3)
(54.3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R:если T2 —T1 =1 К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты
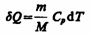
его внутренняя энергия возрастает на величину (согласно формуле (53.4))
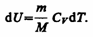
При этом газ совершит работу, определяемую выражением (54.3).
Изотермический процесс (T=const). Как уже указывалось, изотермический процесс описывается законом Бойля—Мариотта:
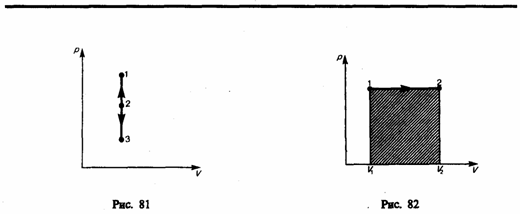
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу (см. рис. 60), расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из выражений (52.2) и (42.5) найдем работу изотермического расширения газа:
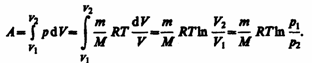
Так как при Т=const внутренняя энергия идеального газа не изменяется:
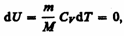
то из первого начала термодинамики (dQ=dU+dA) следует, что для изотермического процесса
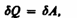
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
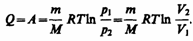 (54.4)
(54.4)
Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
Билет 16
ли лежащий на земле мяч слегка толкнуть ногой, то он, прокатившись по земле, остановится, а вся его кинетическая энергия перейдёт в тепловую, в результате чего он сам и участки земли, которых он касался, станут чуть теплее. Другими словами, вся кинетическая энергия упорядоченного движения мяча переходит во внутреннюю энергию хаотического движения молекул. А можно ли сделать наоборот, чтобы часть энергии хаотического движения молекул перешла в кинетическую энергию его упорядоченного движения, как целого? В принципе, можно себе представить, что совершенно случайно все молекулы мяча в своём тепловом движении вдруг начинают двигаться в одном направлении. Тогда очевидно, что и весь мяч двинется в ту же сторону. Интересно, что такая случайная координация между движениями всех молекул не противоречит закону сохранения энергии, но жизненный опыт нам подсказывает, что этого быть не может, т.к. вероятность такого события очень и очень мала. Таким образом, процесс скольжения мяча является необратимым, при котором вся кинетическая энергия переходит в тепловую, а упорядоченное движение заменяется хаотичным.
Можно привести много примеров необратимости тепловых процессов. Если два тела разной температуры соприкасаются, то более горячее тело остывает, а более холодное нагревается, хотя закон сохранения энергии, вообще говоря, не запрещает и обратное. Поэтому теплообмен между неодинаково нагретыми телами тоже необратим и происходит только от более нагретого тела к менее нагретому (рис. 32а). Можно считать, что до начала теплообмена молекулы были расположены упорядоченно – молекулы с малой кинетической энергией в менее нагретом теле, а молекулы с большой энергией в более нагретом. Таким образом, как и в случае с катящимся по полю мячом, теплообмен происходит в направлении от порядка к его отсутствию.
Свойство газа занимать весь объём сосуда, в котором он находится, тоже возникает из-за стремления молекул газа к беспорядку. Если сначала разместить все молекулы газа в какой-то малой части сосуда, а потом снять ограничения, разрешив им двигаться, то они равномерно заполнят весь его объём (рис. 32б). Как и в предыдущих случаях, вероятность того, что молекулы опять соберутся все вместе в той части сосуда, где они были сначала, ничтожно мала. Поэтому и этот процесс расширения газа тоже необратим.
Таким образом, можно утверждать, что, если замкнутая система из макроскопических тел переходит в другое состояние, то этот переход необратим, т.к. он всегда происходит из менее вероятного состояния в более вероятное. Это утверждение называют вторым законом термодинамики, который указывает направление протекания тепловых процессов в природе.
Существуют, однако, и несколько других формулировок второго закона термодинамики. Одна из них принадлежит немецкому учёному Р. Клаузису – «Невозможен процесс, единственным результатом которого был бы переход количества теплоты от холодного тела к горячему». Другими словами, теплообмен в замкнутой системе может происходить только в одном направлении – от горячего тела к холодному.
Докажем с помощью второго закона термодинамики в формулировке Клаузиса, что количество теплоты, полученное при охлаждении какого-либо тела А не может быть полностью преобразовано в механическую энергию тела Б. Действительно, если бы это удалось, то тогда можно было бы нагреть любое тело В, более горячее, чем А, с помощью силы трения, возникающей при движении тела Б по телу В. В результате, система из тел А,Б и В перешла бы в новое состояние, отличное от старого только тем, что некоторое количество теплоты перешло от тела А к более горячему телу В. А такой процесс запрещён вторым законом термодинамики, и значит, всё количество теплоты не может быть преобразовано в механическую энергию.
Потребности человеческого общества в различных видах энергии возрастают с каждым годом. При этом большая часть электрической и механической энергии производится тепловыми двигателями, в частности, двигателями внутреннего сгорания, КПД которых ограничен вторым законом термодинамики и уравнением (31.2). И, чем больше человечество производит энергии, тем больше оно нагревает окружающую среду и загрязняет её экологически вредными продуктами сгорания. Поэтому будущее мировой энергетики связано с использованием энергосберегающих технологий и возобновляемых источников энергии (ветер, приливы, солнечная энергия и т.п.).
второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии.
Приведем второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (1865): Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния 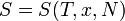 , называемая энтропией, такая, что ее полный дифференциал
, называемая энтропией, такая, что ее полный дифференциал 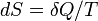 . [3]
. [3]
2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
Принцип действия тепловой машины: от термостата с более высокой температурой Т1 наз. нагревателем за цикл отнимается кол-во теплоты Q1, а термостату с более низкой температурой Т2 наз. холодильником, за цикл передается кол-во теплоты Q2, при этом совершается работа A=Q1-Q2 .
Принцип действия холодильной машины: за цикл от термостата с более низкой температурой Т2 отнимается кол-во теплоты Q2 и отдаётся термостату с более высокой температурой Т1 кол-во теплоты Q1 .
Без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать её более нагретому.
Билет 17 Кипе́ние — процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
С ростом давления растет температура кипения
Критическая точка – это последняя точка на фазовой кривой, разделяющей жидкое и газообразное состояние. Для воды критическая температура = 647 K, а давление 218,3 атм. Таким образом воду можно превратить в пар (без кипения), если ее сначала сжать до критического давления (чуть выше), а потом нагреть выше критической температуры. Давления можно уменьшать – вода перешла в газообразное состояние.
В непосредственной близости от критической точки вещество оказывается в крайне неустойчивом состоянии (критическим). Немного увеличим температуру - вода бурно кипит, снизим - конденсируется. В критическом состоянии флуктуации становятся очень большими, что приводит к резкому изменению теплопроводности, меняется скорость звука и сильно увеличивается количество рассеиваемого света.
Билет 18
Влажность — показатель содержания воды в физических телах или средах. Для измерения влажности используются различные единицы, часто внесистемные.
Температура точки росы газа (точка росы) — это значение температуры газа, при достижении которой водяной пар, содержащийся в газе, охлаждаемом изобарически, становится насыщенным над плоской поверхностью воды
Гигрометр — измерительный прибор для определения влажности воздуха. Существует несколько типов гигрометров, действие которых основано на различных принципах: весовой, волосной, плёночный и прочих.
Билет 19
сохраняет объём, принимает форму сосуда, текуча.
Молекулы, находящиеся на поверхности жидкости, имеют избыток потенциальной энергии и поэтому стремятся втянуться внутрь так, что при этом на поверхности остается минимальное количество молекул. За счет этого вдоль поверхности жидкости всегда действует сила, стремящаяся сократить поверхность. Это явление в физике получило название поверхностного натяжения жидкости.
Поверхностное натяжение является одним из важных параметров воды . Оно определяет силу сцепления между молекулами воды, а также форму поверхности жидкости. Например, из-за сил поверхностного натяжения формируется капля, лужица, струя и т.д. Летучесть (испаряемость) жидкости тоже зависит от сил сцепления молекул. Чем меньше поверхностное натяжение, тем более летуча жидкость. Самым низким поверхностным натяжением обладают спирты и растворители. Это, в свою очередь, определяет их активность, т.е. способность взаимодействовать с другими веществами.
Если бы вода имела низкое поверхностное натяжение, она бы улетучилась или испарилась. При выливании воды из сосуда с широким горлом на поверхности воды на мгновение образуется выпуклость и определенное время она удерживается силами межмолекулярного сцепления. Потом происходит разрыв «верхней пленки» и жидкость выливается. Зрительно поверхностное натяжение можно представить следующим образом: если медленно наливать в чашку чай до краев, то какое-то время он не будет выливаться через край и в проходящем свете можно увидеть, что над поверхностью жидкости образовалась тончайшая пленка, которая не дает чаю выливаться. Она набухает по мере доливания, и только при, как говорится, «последней капле» жидкость выливается через край.
Сма́чивание — это поверхностное явление, заключающееся во взаимодействии жидкости с поверхностью твёрдого тела или другой жидкости. Смачивание бывает двух видов:
- Иммерсионное (вся поверхность твёрдого тела контактирует с жидкостью)
- Контактное (состоит из трёх фаз — твердая, жидкая, газообразная)
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, не смачивающие – опускаются.
Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести  действующая на столб жидкости в капилляре, не станет равной по модулю результирующей Fн сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: Fт = Fн, где Fт = mg = ρhπr2g, Fн = σ2πr cos θ.
действующая на столб жидкости в капилляре, не станет равной по модулю результирующей Fн сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: Fт = Fн, где Fт = mg = ρhπr2g, Fн = σ2πr cos θ.
Отсюда следует:
|
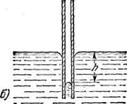 |
Искривление поверхности жидкости в узких трубках приводит к кажущемуся нарушению закона сообщающихся сосудов.
Рис.6(б)
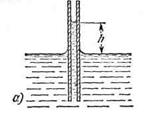
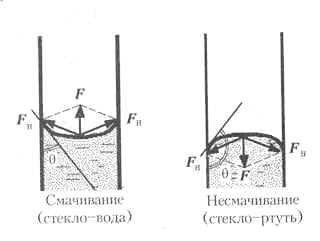
Рис.6(а)
Из формулы видно, что высота h тем больше, чем меньше внутренний радиус трубки ч. Подъем воды имеет значительную величину в трубках, внутренний диаметр которых соизмерим с диаметром волоса (или еще меньше); поэтому такие трубки называют капиллярами (от греческого «капиллярис» — волосной, тонкий). Смачивающая жидкость в капиллярах поднимается вверх (рис.6, а), а несмачивающая — опускается вниз (рис.6, б). Явления, обусловленные втягиванием смачивающих жидкостей в капилляры или выталкиванием несмачивающих жидкостей из капилляров, называются к а пиллярными явлениям и.
Капиллярные явления можно наблюдать не только в трубках,
но и в узких щелях. Если опустить в воду две стеклянные пластины так, чтобы между ними образовалась узкая щель, то вода между пластинами поднимется, и тем выше, чем ближе они расположены. Капиллярные явления играют большую роль в природе и технике. Множество мельчайших капилляров имеется в растениях. В деревьях по капиллярам влага из почвы поднимается до вершин деревьев, где через листья испаряется в атмосферу. В почве имеются капилляры, которые тем уже, чем плотнее почва. Вода по этим капиллярам поднимается до поверхности и быстро испаряется, а земля становится сухой. Ранняя весенняя вспашка земли разрушает капилляры, т. е. сохраняет подпочвенную влагу и увеличивает урожай.
В технике капиллярные явления имеют огромное значение, например, в процессах сушки капиллярно-пористых тел и т. п. Большое значение капиллярные явления имеют в строительном деле. Например, чтобы кирпичная стена не сырела, между фундаментом дома и стеной делают прокладку из вещества, в котором нет капилляров. В бумажной промышленности приходится учитывать капиллярность при изготовлении различных сортов бумаги. Например, при изготовлении писчей бумаги ее пропитывают специальным составом, закупоривающим капилляры. В быту капиллярные явления используют в фитилях, в промокательной бумаге, в перьях для подачи чернил и т. п.
Билет 20
Твёрдое тело — это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия
Билет 21
Плавлением называют процесс перехода вещества из твердого кристаллического состояния в жидкое. Плавление происходит при постоянной температуре с поглощением тепла. Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. При этом среднее расстояние между атомами и, следовательно, силы взаимодействия изменяется незначительно. Температура плавления для данного кристалла ? его важная характеристика, но она не является величиной постоянной, а существенным образом зависит от внешнего давления, при котором происходит плавление. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. Более высокая температура.
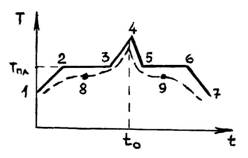
На рис. 1 представлена зависимость температуры нагреваемого кристалла от времени.
 |
| рис. 1 |
На участке 12 происходит нагревание кристалла. При достижении температуры tпл вся поступающая теплота идет на плавление кристалла (участок 23), нагревания его не происходит.
Количество теплоты qпл, необходимое для превращения одного моля кристалла в жидкое состояние при постоянной температуре плавления, называют молярной скрытой теплотой плавления. Каждому кристаллу присуща своя величина теплоты плавления.
Отметим, что усиление или ослабление подвода тепла на участке 23 вызывает только ускорение или замедление процесса плавления, не изменяя величины tпл. Если прекратить подвод тепла, то останавливается и процесс плавления, т. е. Двухфазной системе жидкость?кристалл устанавливается равновесное состояние, когда числа молекул, переходящих в единицу времени из твердой фазы в жидкую и обратно, равны.
На участке 34 происходит процесс нагревания жидкости. Если в момент времени t0 остановить нагревание жидкости, то возникнет обратный процесс охлаждения жидкости (участок 45). Когда температура достигнет температуры плавления, начнется кристаллизация жидкости (участок 56). Как только процесс кристаллизации заканчивается (точка 6), дальнейший отвод тепла сопровождается понижением температура (участок 67).
В кристалле, как мы знаем, каждая молекула совершает только колебательное движение, тогда как в жидкости она совершает еще и поступательное движение. Поэтому при кристаллизации от вещества необходимо отводить тепловую энергию, соответствующую поступательному движению молекул. Молекулы, утратившие этот излишек энергии, присоединяются к кристаллам.
У аморфных тел изменение температуры со временем (пунктирная кривая на рис. 5.3.1) не имеет участка с постоянной температурой, а только точку перегиба (8 или 9). Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости. У аморфных тел нельзя указать такую определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже ? твердое состояние. Выделяется только температура, соответствующая точке перегиба. Эту температуру условно называют температурой размягчения аморфных тел.
Билет 22
Электромагнитноеполе- это особая форма материи, посредством которой осуществляется взаимодействие между заряженными частицами. Представляет собой взаимосвязан ные переменные электрическое поле и магнитное поле. Взаимная связь электрического Е и магнитного Н полей заключается в том, что всякое изменение одного из них приводит к появ лению другого: переменное электрическое поле, порождаемое уско ренно движущимися зарядами (источником), возбуждает в смежных областях пространства переменное магнитное поле, которое, в свою очередь, возбуждает в прилегающих к нему областях пространства переменное электрическое поле.
Электрическое поле представляет собой частную форму проявления электромагнитного поля. В своем проявлении это силовое поле, основным свойством которого является способность воздействовать на внесенный в него электрический заряд с силой, не зависящей от скорости заряда. Источниками электрического поля могут быть электрические заряды (движущиеся и неподвижные) и изменяющиеся во времени магнитные поля.
Магнитное поле представляет собой частную форму электромагнитного поля. В своем проявлении это силовое поле, основным свойством которого является способность воздействовать на движущиеся электрические заряды (в т.ч. на проводники с током), а также на магнитные тела независимо от состояния их движения. Источниками магнитного поля могут быть движущиеся электрические заряды (проводники с током), намагниченные тела и изменяющиеся во времени электрические поля.
Источниками электромагнитных излучений радиочастот (ЭМИ РЧ) и сверхвысоких частот (СВЧ) являются технические средства и изделия, которые предназначены для применения в различных сферах человеческой деятельности и в основе которых используются физические свойства этих излучений: распространение в пространстве и отражение, нагрев материалов, взаимодействие с веществами.
Электромагнитное поле имеет двойную физическую природу. Это два взаимосвязанных поля – электрическое и магнитное. Только в особых случаях их можно разделить, но это будут всего лишь частные варианты того же электромагнитного поля.
Материальность электромагнитного поля проявляется физически в том, что оно производит силовое действие на частицы, обладающие электрическим зарядом, электрическим или магнитным моментами, а так же в том, что оно обладает энергией, массой и импульсом. При таких свойствах электромагнитное поле проявляет себя как реальный вид материи, а не как теоретическая модель, оторванная от реальности.
Тела, способные после натирания притягивать легкие предметы, называют наэлектризованными. Степень электризации тел в результате взаимного трения характеризуется величиной и знаком электрического заряда, полученного телом. Например, эбонитовая палочка, потертая о мех, электризуется отрицательно, а стеклянная палочка, потертая о шелк, электризуется положительно.
Знак заряда тел в результате электризации определяется тем, что одни вещества при трении отдают электроны, а другие их присоединяют.
В атомах тех веществ, где электрон находится далеко от ядра и слабо с ним связан (например, в стекле), энергия связи электрона с атомом мала. Электрон может легко оторваться от атома. Атом при этом превращается в положительный ион, а вещество (стеклянная палочка) заряжается положительно.
В других веществах (например, в шелке) ядро атома сильно удерживает электрон. Атом этого вещества может присоединить к себе дополнительный электрон, образуя отрицательный ион. Вещество (шелк) при этом заряжается отрицательно. В результате трения стекло заряжается положительно, а шелк — отрицательно. Иными словами, электрические заряды не создаются и не исчезают, они лишь перераспределяются между контактирующими телами.
Система тел, которая не взаимодействует с окружающими телами, называется замкнутой или изолированной системой тел.
Явление электризации тел подчиняется закону сохранения электрического заряда: во всех явлениях электризации тел в замкнутой системе суммарный электрический заряд сохраняется.
Многочисленные опыты показывают, что тела, имеющие электрические заряды одинакового знака, взаимно отталкиваются, а тела, имеющие заряды противоположного знака, взаимно притягиваются.
На основе взаимодействия зарядов одинакового знака работают приборы: электроскоп и электрометр, с помощью которых можно обнаружить наличие заряда и определить его знак.
Билет 23
Зако́н Куло́на — это закон, описывающий силы взаимодействия между точечными электрическими зарядами.
Был открыт Шарлем Кулоном в 1785 г. Проведя большое количество опытов с металлическими шариками, Шарль Кулон дал такую формулировку закона:
Модуль силы взаимодействия двух точечных зарядов в вакууме прямо пропорционален произведению модулей этих зарядов и обратно пропорционален квадрату расстояния между ними
Иначе: Два точечных заряда в вакууме действуют друг на друга с силами, которые пропорциональны произведению модулей этих зарядов, обратно пропорциональны квадрату расстояния между ними и направлены вдоль прямой, соединяющей эти заряды. Эти силы называются электростатическими (кулоновскими).
Важно отметить, что для того, чтобы закон был верен, необходимы:
1. точечность зарядов — то есть расстояние между заряженными телами много больше их размеров — впрочем, можно доказать, что сила взаимодействия двух объёмно распределённых зарядов со сферически симметричными непересекающимися пространственными распределениями равна силе взаимодействия двух эквивалентных точечных зарядов, размещённых в центрах сферической симметрии;
2. их неподвижность. Иначе вступаю