Уравнение равновесия жидкости
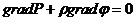
Уравнение Бернулли
В установившемся движении идеальной жидкости полное давление, слагающееся из динамического, гидростатического и статического, одинаково для всех поперечных сечений трубки тока.
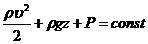
Молекулярно-кинетическая теория (МКТ)устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает связь давления газа со средней кинетической энергией поступательного движения молекул.
Формулировка
давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Макроскопические параметры
- количество вещества
- объем
- температура
- давление
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
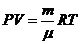
Основное уравнение молекулярно-кинетической теории
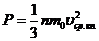
Из основного уравнения молекулярно-кинетической теории следует закон Авогадро: в равных объемах разнородных газов при одинаковых условиях (одинаковой температуре и одинаковом давлении) содержится одинаковое число молекул.
Число степеней свободы
Число степеней свободы – наименьшее число независимых координат, определяющих положение и конфигурацию молекулы в пространстве
Число степеней свободы:
- для одноатомной молекулы -3 (поступательное движение в направлении трех координатных осей),
- для двухатомной - 5 ( три поступательных и две вращательных, т.к. вращение вокруг оси Х возможно только при очень высоких температурах),
- для трехатомной -6 ( три поступательных и три вращательных).
теорема о равнораспределении кинетической энергии по степеням свободы позволяет связать температуру системы с её средней энергией.
Содержание теоремы:
на все степени свободы статистической системы приходится одна и та же энергия 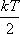 .
.
Внутренняя энергия идеального газа
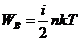
Для одного моля газа
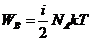
Для любой массы газа, т.е. для любого числа киломолей
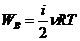
Работа газа при изменении его объёма
Изобарический процесс
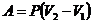
Изотермический процесс
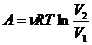
Изохорический процесс
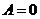
Первое начало термодинамики
Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии.
Формулировка:
- теплота, переданная системе, и работа, совершенная над системой, направлены на изменение внутренней энергии системы
- при переходе системы между двумя состояниями изменение внутренней энергии не зависит от вида процесса, посредством которого произведен этот переход.
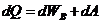
Изобарический процесс
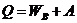
Изохорический процесс
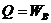
Изотермический процесс
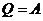
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δT, которое при этом произошло
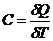
Тепловая машина
Тепловые машины подразделяются на тепловые двигатели и холодильные установки. Работа тепловой машины может быть сведена к взаимодействию трех элементов: нагревателя, холодильника и рабочего тела. Тепловые двигатели предназначены для преобразования теплоты в работу.
При выполнении цикла рабочее тело получает от нагревателя теплоту Q1, отдаёт холодильнику теплоту Q2 и разность этих теплот преобразует в полезную работу
A = Q1 – Q2
Эффективность двигателя характеризуется его коэффициентом полезного действия, определяемым как отношение полезной работы к полученной теплоте:
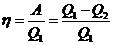
Холодильные установки предназначены для производства холода. При выполнении цикла рабочее тело забирает от холодильника теплоту Q2, получает из внешней среды работу A и передаёт нагревателю теплоту Q1 = Q2 + A
Цикл Карно
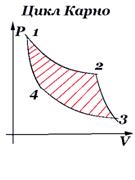 Состоит из двух изотерм и двух адиабат. В двигателе этот цикл проходит по часовой стрелке, в холодильной установке – в противоположном направлении. В точке 1 рабочее тело приводится в контакт с нагревателем и, находясь в этом контакте, изотермически расширяется при температуре T1 до состояния 2. При этом от нагревателя забирается теплота и совершается положительная работа расширения. В точке 2 прекращается контакт с нагревателем и рабочее тело адиабатически расширяется до состояния 3. При этом совершается положительная работа, убывает внутренняя энергия и уменьшается температура тела. В точке 3 рабочее тело приводится в контакт с холодильником и, находясь в этом контакте, изотермически сжимается действием внешних сил при температуре T2. При этом совершается отрицательная работа сжатия и холодильнику передаётся часть полученной от нагревателя теплоты. В точке 4 прекращается контакт с холодильником и рабочее тело адиабатически сжимается действием внешних сил до исходного состояния 1. При этом совершается отрицательная работа сжатия и увеличивается внутренняя энергия и температура тела.
Состоит из двух изотерм и двух адиабат. В двигателе этот цикл проходит по часовой стрелке, в холодильной установке – в противоположном направлении. В точке 1 рабочее тело приводится в контакт с нагревателем и, находясь в этом контакте, изотермически расширяется при температуре T1 до состояния 2. При этом от нагревателя забирается теплота и совершается положительная работа расширения. В точке 2 прекращается контакт с нагревателем и рабочее тело адиабатически расширяется до состояния 3. При этом совершается положительная работа, убывает внутренняя энергия и уменьшается температура тела. В точке 3 рабочее тело приводится в контакт с холодильником и, находясь в этом контакте, изотермически сжимается действием внешних сил при температуре T2. При этом совершается отрицательная работа сжатия и холодильнику передаётся часть полученной от нагревателя теплоты. В точке 4 прекращается контакт с холодильником и рабочее тело адиабатически сжимается действием внешних сил до исходного состояния 1. При этом совершается отрицательная работа сжатия и увеличивается внутренняя энергия и температура тела.
КПД цикла Карно
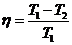
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Формулировки
Существуют несколько эквивалентных формулировок второго начала термодинамики:
- Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
- Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
- «Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Энтропией называется функция состояния, изменение которой при обратимом переходе между состояниями выражается как интеграл 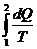 , взятый по любой кривой, характеризующей обратимый переход между этими состояниями.
, взятый по любой кривой, характеризующей обратимый переход между этими состояниями.
Свойства энтропии:
1. Энтропия изолированной системы при протекании необратимого процесса возрастает.
2. Энтропия системы, находящейся в равновесном состоянии, максимальна.
