Стандартный электродный потенциал
Значение стандартного электродного потенциала не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного электрода. Стандартные потенциалы (табличные величины) отнесены к 25оС; их значения при других Т могут быть найдены по температурным коэффициентам, также сведенным в таблицу.
Стандартные потенциалы используются при решении многих проблем, связанных с химическим равновесием в растворах.
Любой электрод, расположенный ниже в ряду стандартных электродных потенциалов (т.е. более положительный), находится в более окисленном состоянии, чем электрод, расположенный выше (пример: элемент Даниэля-Якоби). Если из двух таких электродов составить электрохимическую систему, то на «нижнем» будет протекать реакция восстановления (Cu), а на «верхнем» - реакция окисления (Zn). Процесс идет в том же направлении, если активные вещества обоих электродов находятся в непосредственном контакте друг с другом и реакция протекает по химическому пути. Равновесие в системе наступит в тот момент, когда потенциалы двух электродных реакций сделаются одинаковыми. Такое состояние достигается при определенном соотношении активностей участников реакции, отвечающем константе ее равновесия.
Пусть взяты редокси-системы Се3+, Се4+ и Fe2+, Fe3+. Электродный потенциал первой системы при 25оС описывается уравнением
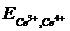 = 1,61 + 0,059 lg
= 1,61 + 0,059 lg 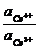
а электродный потенциал второй -
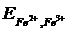 = 0,77 + 0,059 lg
= 0,77 + 0,059 lg 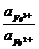
Равновесие в системе, содержащей ионы церия и железа, установится, когда их потенциалы будут одинаковыми:
1,61 + 0,059 lg 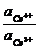 = 0,77 + 0,059 lg
= 0,77 + 0,059 lg 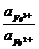
Следовательно, в состоянии равновесия
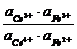 =
= 
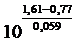 = 1014
= 1014
При добавлении к раствору, содержащему ионы Fe2+ и Fe3+, раствора, содержащего ионы Се3+ и Се4+, реакция будет протекать в сторону окисления ионов Fe2+ и восстановления ионов Се4+ ; в состоянии равновесия железо будет практически полностью окислено до ионов Fe3+, а церий восстановлен до ионов Се3+. Высокий окислительный потенциал системы Се3+, Се4+ дает возможность использовать ее в химическом объемном анализе (цериметрия).
Подобная же картина наблюдается при смешении растворов Fe2+, Fe3+ и Sn2+, Sn4+ , когда железо восстанавливается, а олово окисляется. В равновесном состоянии, как это следует из стандартных потенциалов,
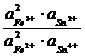 =
= 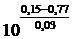 = 10–20,7
= 10–20,7
почти все растворенное железо будет присутствовать в форме ионов Fe2+. Растворы солей олова (II) применяются поэтому для количественного восстановления ионов Fe3+ до ионов Fe2+ и при проведении ряда других реакций восстановления.
Аналогичные явления лежат в основе процесса вытеснения металлов из растворов их солей другими металлами, расположенными ближе к началу ряда стандартных электродных потенциалов. Этот процесс называется цементацией или контактным вытеснением и широко используется в технике. На практике часто встречаются случаи контактного вытеснения меди железом из растворов ее простых солей. Здесь, как это следует из значений стандартных потенциалов, в состоянии равновесия
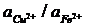 = 10–26
= 10–26
Следовательно, если с раствором соли меди контактирует достаточное количество металлического железа, то процессы растворения железа и осаждения меди будут продолжаться до тех пор, пока отношение активностей их ионов не начнет удовлетворять вышеприведенному уравнению (раствор практически полностью освобожден от ионов Cu2+).
Если электроды расположены в ряду стандартных электродных потенциалов близко друг к другу, как, например, Sn2+, Sn4+ и Cu+, Cu2+, то константа равновесия редокси-реакции мало отличается от 1, и при смешении растворов, содержащих такие редокси-пары, окислительно-восстановительное равновесие смещается не очень заметно.
Большинство электрохимических процессов протекает в контакте с водой и воздухом. Поэтому особенно важным, с практической и теоретической точек зрения, является положение данного электрода в ряду стандартных электродных потенциалов относительно электродов H+ êH2 êPt и OH– êO2 êPt .
Все электроды с потенциалом более отрицательным, чем потенциал водородного электрода, в водных растворах термодинамически неустойчивы. Реакции, отвечающие таким электродам, должны протекать самопроизвольно в сторону получения более окисленных веществ с одновременным разложением воды и выделением из нее газообразного водорода. Так, например, металлический натрий ( 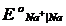 = - 2,71 В) должен разлагать воду и переходить в ионное состояние по уравнению:
= - 2,71 В) должен разлагать воду и переходить в ионное состояние по уравнению:
Na + H2O = Na+ + 1/2 H2 + OH– 
Точно так же, поскольку стандартный потенциал редокси-системы Ti2+, Ti3+ значительно отрицательнее потенциала водородного электрода ( 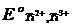 = -0,37 В), в водных растворах солей титана (II) должно самопроизвольно протекать окисление ионов Ti2+ до ионов Ti3+ с одновременным разложением воды.
= -0,37 В), в водных растворах солей титана (II) должно самопроизвольно протекать окисление ионов Ti2+ до ионов Ti3+ с одновременным разложением воды.
Все электроды, потенциалы которых менее положительны, чем потенциал кислородного электрода, термодинамически неустойчивы в контакте с воздухом и водой. В этих случаях наблюдается самопроизвольное восстановление кислорода и превращение его в воду (или в пероксид водорода) с одновременным окислением соответствующих металлов или других веществ. Так, например, металлическое железо ( 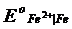 = -0,44 В) реагирует с кислородом воздуха:
= -0,44 В) реагирует с кислородом воздуха:
Fe + 1/2 O2 + H2O = Fe2+ + 2OH–
Ионы Cu+ ( 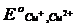 = + 0,154 В) также самопроизвольно окисляются в растворе до ионов Cu2+ :
= + 0,154 В) также самопроизвольно окисляются в растворе до ионов Cu2+ :
Cu+ + 1/4 O2 + 1/2 H2O = Cu2+ + OH–
Металлическая медь ( 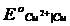 = + 0,34 В) переходит в состояние двухвалентных ионов:
= + 0,34 В) переходит в состояние двухвалентных ионов:
Cu + 1/2 O2 + H2O = Cu2+ + 2OH–
Т.о., если электрод расположен в ряду стандартных электродных потенциалов между водородным и кислородным электродами, то при его контакте с раствором разложение воды с выделением водорода будет термодинамически невероятно. Однако остается возможной реакция восстановления кислорода, поэтому такой электрод должен быть термодинамически неустойчив в присутствии воды и воздуха. Если же водный раствор обезгазить и воздух над ним заменить инертной атмосферой, тогда восстановление кислорода будет исключено и электрод станет термодинамически устойчивым. В этих условиях можно реализовать обратимый потенциал электрода и измерить его относительно соответствующего электрода сравнения.
Электроды с потенциалами более положительными, чем у равновесного кислородного электрода, термодинамически неустойчивы и должны разлагать воду с выделением газообразного кислорода. Например, судя по стандартному потенциалу системы Се4+, Се3+ (+ 1,61 В), ионы Се4+ в водных растворах должны самопроизвольно восстанавливаться с одновременным разложением воды и образованием кислорода:
Се4+ + 1/2 Н2О = Се3+ + 1/4 О2 + Н+
Классификация электродов. Электроды первого и второго рода, газовые электроды, амальгамные электроды, окислительно-восстановительные электроды, правило Лютера. Применение электродов (электроды сравнения, индикаторные электроды и пр.)
Классификация электродов
Если на электроде протекает частная реакция
nA A + ... + nF = nL L + ... ,
то потенциал электрода определяется уравнением
E = Eо +  ln
ln 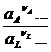 ,
,
то есть при заданных Т и р определяется (кроме Eо, который является константой) активностями веществ, участвующих в электродной реакции. Характер влияния активностей компонентов раствора на значение E связан с природой электродной реакции и лежит в основе классификации электродов. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые специальные типы электродов.
Электроды первого рода
Электроды первого рода представляют собой металл или металлоид (то есть неметалл с электронной проводимостью), погруженные в раствор своей соли. Электроды первого рода можно схематически представить в виде Мn+ êМ (если электрод - металл) или в виде Меn– êМе (если электрод - металлоид). Электродную реакцию записывают как
Mn+ + ne ® M или Me + ne ® Men– ;
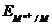 =
= 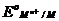 +
+  ln
ln 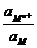 =
= 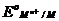 + 2,303
+ 2,303  lg
lg 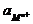 ;
;
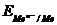 =
= 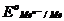 +
+  ln
ln 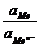 =
= 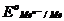 - 2,303
- 2,303  lg
lg 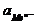
(так как активность чистого твердого вещества при заданной температуре постоянна и можно принять ее условно равной 1).
Из уравнений следует, что потенциал электрода первого рода зависит от активности лишь одного вида ионов; эти ионы называются потенциалоопределяющими. В случае металлических электродов первого рода такими ионами являются катионы металла, а в случае металлоидных электродов - анионы металлоида. Примеры металлических электродов: металл, погруженный в раствор своей соли (Ag в растворе AgNO3 - Ag+ êAg ; Cu в растворе CuSO4 - Cu2+ êCu). Пример металлоидных электродов первого рода - селеновый электрод Se2– êSe.
Металлические электроды первого рода имеют большое практическое значение и легче реализуются, чем металлоидные.
Следует отметить, что в водных растворах нельзя реализовать как электроды первого рода электроды, обратимые по отношению к ионам щелочных и щелочноземельных металлов, так как в этом случае вместо обратимой реакции разряда-ионизации металла на электроде идет необратимый процесс разложения воды с выделением водорода:
Na + H2O = Na+ + 1/2 H2 + OH– . 
Причина – большое отрицательное значение потенциалов этих электродов.
Электроды второго рода
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида, гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить как An– êMA êM , а протекающую в нем реакцию
MA + ne = M + An– ;
 =
= 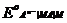 + 2,303
+ 2,303  lg
lg 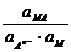 =
= 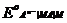 - 2,303
- 2,303  lg
lg 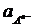
(учитывая, что активности металла и твердого соединения МА постоянны).
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Однако электроды второго рода обратимы и по отношению к катионам электродного металла:
ПРМА = 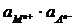 ;
;
 =
= 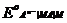 - 2,303
- 2,303  lg ПРМА + 2,303
lg ПРМА + 2,303  lg
lg 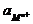 =
=
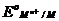 + 2,303
+ 2,303  lg
lg 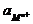 =
= 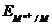 .
.
Из сопоставления потенциалов соответствующих электродов первого и второго рода можно найти ПР труднорастворимых солей.
Потенциалы электродов второго рода легко воспроизводимы и устойчивы, поэтому эти электроды часто применяют в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, ртутно-сульфатные, хлоридсеребряные, ртутнооксидные и сурьмяные электроды.
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД. Это ртуть, покрытая пастой из смеси каломели со ртутью, находящаяся в контакте с раствором KCl:
Cl– êHg2Cl2 êHg .
Электродная реакция: Hg2Cl2 + 2e = Hg + 2 Cl– ;
Eкал = Eокал - 2,303 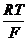 lg
lg 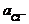 .
.
При 25оС Eкал = + 0,2678 - 0,059 lg 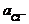 .
.
Eкал определяется активностью ионов Cl–. Наиболее часто употребляются каломельные полуэлементы, в которых концентрация KCl - насыщенный раствор, 1.0 М или 0.1 М. Каломельные электроды, особенно насыщенный, удобны тем, что диффузионный потенциал, возникающий на границе данного раствора с насыщенным KCl, незначителен и во многих случаях его можно не принимать во внимание.
РТУТНО-СУЛЬФАТНЫЙ ЭЛЕКТРОД SO42– êHg2SO4 êHg аналогичен каломельному, ртуть покрыта слоем пасты из ртути и сульфата ртути (I), а в качестве раствора используется H2SO4. При 25оС
Eрт.с. = + 0,6156 - 0,0296 lg 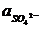 .
.
ХЛОРИДСЕРЕБРЯНЫЙ ЭЛЕКТРОД представляет собой систему
Cl– êAgCl êAg ;
Eхс = Eохс - 2,303 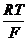 lg
lg 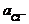 = + 0,2224 - 0,059 lg
= + 0,2224 - 0,059 lg 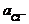 .
.
Ртутно-сульфатный и хлоридсеребряный электроды целесообразно применять в тех случаях, когда исследуемый полуэлемент содержит в качестве электролита либо серную кислоту или сульфаты, либо соляную кислоту или хлориды. Чтобы уменьшить величину диффузионного потенциала, концентрацию этих электролитов в электродах сравнения следует брать такую же, как и в исследуемых полуэлементах.
МЕТАЛЛОКСИДНЫЕ ЭЛЕКТРОДЫ интересны тем, что здесь в роли анионов труднорастворимого соединения электродного металла выступают ионы гидроксида. К ним относятся, например, ртутнооксидный и сурьмяный электроды:
OH– êHgO êHg и OH– êSb2O3 êSb .
Уравнения электродных реакций и потенциалов этих электродов:
HgO + H2O + 2e = Hg + 2OH– Eрт.окс. = Eорт.окс. - 2,303 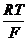 lg
lg 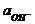 ;
;
Sb2O3 + 3H2O + 6e = 2Sb + 6OH– Eсурьм. = Eосурьм. - 2,303 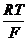 lg
lg 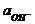 .
.
Уравнения для электродного потенциала получены при допущении, что постоянны активности не только соответствующих металлов и их оксидов, но и воды, также принимающей участие в электродной реакции.
Металлоксидные электрода второго рода, как и металлсолевые электроды второго рода, обратимы по отношению не только к ионам гидроксила, но и к ионам электродного металла. Кроме того, они обратимы и по отношению к ионам водорода, потому что ионное произведение воды при заданной Т постоянно для любого водного раствора электролита.
Металлоксидные электроды можно применять как электроды сравнения в любых растворах кислот и щелочей, однако ртутнооксидный электрод вследствие заметной растворимости оксидов ртути в кислотах можно рекомендовать лишь для растворов с рН > 7. Сурьмяный электрод из-за неустойчивости состава его поверхностного оксида применять как электрод сравнения нельзя; он используется в качестве индикаторного электрода для приближенных определений рН в умеренно кислых и нейтральных растворах.
Газовые электроды
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Конструирование газового электрода невозможно без участия проводника с электронной проводимостью. Требования к металлу в газовых электродах: 1) должен ускорять медленно устанавливающееся электродное равновесие, то есть служить катализатором электродной реакции; 2) потенциал металла в газовом электроде не должен зависеть от активности других ионов раствора, в частности от активности собственных ионов металла; 3) должен быть инертным по отношению к другим возможным реакциям; 4) должен обеспечивать создание максимально развитой поверхности раздела между фазами, на которой могла бы протекать обратимая реакция ионизации газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). Газовые электроды очень чувствительны к изменению состояния поверхности платины, особенно к отравлению ее каталитическими ядами.
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода:
H+ êH2 êPt .
Электродная реакция: 2Н+ + 2е = Н2 ;
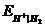 =
= 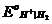 + 2,303
+ 2,303 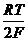 lg
lg 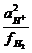 = 2,303
= 2,303 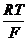 lg
lg 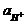 - 2,303
- 2,303 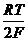 lg
lg 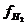
(так как 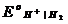 при всех Т принят равным нулю). При невысоких давлениях газообразного водорода (f ® р) летучесть можно заменить на давление:
при всех Т принят равным нулю). При невысоких давлениях газообразного водорода (f ® р) летучесть можно заменить на давление:
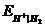 = 2,303
= 2,303 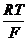 lg
lg 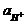 - 2,303
- 2,303 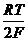 lg
lg 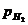 .
.
Таким образом, потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода, следовательно, водородный электрод (как и все газовые электроды) более сложен, чем электроды первого и второго рода, потенциалы которых зависят непосредственно от активности частиц одного сорта.
Когда парциальное давление водорода равно 1 атм, уравнение упрощается: 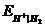 = - 2,303
= - 2,303 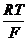 рН , то есть при определенных условиях потенциал водородного электрода дает непосредственное значение рН и, следовательно, его можно использовать как индикаторный электрод при определении рН в растворах кислот и щелочей любых концентраций, что очень существенно, так как другие индикаторные электроды (стеклянный, хингидронный, металлоксидные) можно использовать лишь в ограниченном интервале рН.
рН , то есть при определенных условиях потенциал водородного электрода дает непосредственное значение рН и, следовательно, его можно использовать как индикаторный электрод при определении рН в растворах кислот и щелочей любых концентраций, что очень существенно, так как другие индикаторные электроды (стеклянный, хингидронный, металлоксидные) можно использовать лишь в ограниченном интервале рН.
Другое важное применение газового водородного электрода: при поддержании постоянного значения рН и давления газообразного водорода его можно использовать как электрод сравнения на границе с любыми кислыми и щелочными растворами, причем диффузионный потенциал можно практически свести к нулю подбором соответствующего раствора в водородном электроде.
КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода:
ОН– êО2 êPt .
Электродная реакция: О2 + 2Н2О + 4е = 4ОН– ;
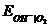 =
= 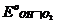 + 2,303
+ 2,303 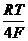 lg
lg 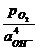 =
=
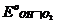 + 2,303
+ 2,303 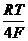 lg
lg 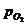 - 2,303
- 2,303 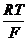 lg
lg 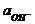 .
.
В величину 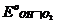 включена активность воды. При 25оС и
включена активность воды. При 25оС и 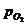 = 1 атм
= 1 атм
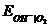 = 0,401 - 0,059 lg
= 0,401 - 0,059 lg 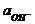 .
.
Однако реализовать обратимый кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, даже платину, поэтому на основную электродную реакцию накладывается реакция, отвечающая металлоксидному электроду второго рода. Кроме того, часть кислорода восстанавливается на электроде не до ионов гидроксила, а до ионов перекиси водорода. Поэтому значения потенциала кислородного электрода, полученные опытным путем, обычно не совпадают с теоретическими, и кислородный электрод не используется на практике ни в качестве индикаторного электрода при определении рН, ни в качестве электрода сравнения, хотя теоретически и то и другое возможно.
ХЛОРНЫЙ ЭЛЕКТРОД. Реализация обратимого газового хлорного электрода Cl– êCl2 êPt связана со значительными трудностями. Теоретически электродная реакция здесь проста: Cl2 + 2e = 2Cl– и электродный потенциал можно описать уравнением
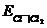 =
= 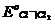 + 2,303
+ 2,303 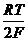 lg
lg 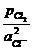 .
.
Однако на основной электродный процесс накладываются побочные реакции с участием хлора. Высокое положительное значение 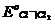 (+ 1,358 В при 25оС) затрудняет подбор устойчивого, не реагирующего с хлором материала электрода. Тем не менее при соблюдении определенных мер удалось получить опытные значения потенциалов хлорного электрода, совпадающие с теоретической величиной.
(+ 1,358 В при 25оС) затрудняет подбор устойчивого, не реагирующего с хлором материала электрода. Тем не менее при соблюдении определенных мер удалось получить опытные значения потенциалов хлорного электрода, совпадающие с теоретической величиной.
Сравнивая выражения для потенциалов газовых электродов, можно заметить, что при повышении давления соответствующего газа потенциал водородного электрода смещается в отрицательную сторону, а потенциалы кислородного и хлорного электродов – в положительную.
Амальгамные электроды
Это полуэлементы, в которых амальгама какого-либо металла находится в контакте с раствором, содержащим ионы этого металла:
Мn+ êMm , Hg , mMn+ + mne ® Mm (Hg) .
Ртуть ведет себя как инертная среда, в которой растворен металл, а потенциалоопределяющими являются ионы этого металла:
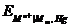 =
=  + 2,303
+ 2,303 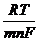 lg
lg 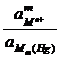 ,
,
то есть потенциал зависит от активности ионов металла не только в растворе, но и в амальгаме.
Амальгамные электроды широко применяются в технике и в лабораторной практике. Кадмиевый амальгамный электрод Cd2+ êCd, Hg (Cd2+ + 2e ® Cd (Hg)) в виде амальгамы, содержащей 12,5% Cd, используется для изготовления нормальных элементов Вестона, ЭДС которых практически не изменяется со временем. Кроме того, амальгамные электроды – практически единственные электроды (если не принимать во внимание ионселективные электроды, их следует рассматривать особо), которые могут быть обратимы по отношению к ионам щелочных и щелочноземельных металлов.
