Нормальный водородный электрод. Стандартный электродный потенциал. Ряд напряжений металлов.
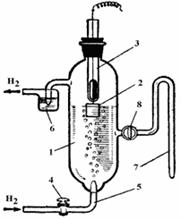
Нормальный водородный электрод состоит из сосуда 1, наполненного 1 М раствором серной кислоты, и пластинки из платины 2, на которую нанесен тонкий шероховатый слой платины. Электрод при помощи платиновой проволоки соединен со ртутью, налитой в стеклянную трубку 3; в ртуть опускают конец внешнего провода. При открытом кране 4 через трубку 5 пропускают под давлением 760 мм.рт.cт. ровную струю тщательно очищенного водорода, который омывает поверхность электрода. Водород выходит в верхней части сосуда через гидравлический затвор 6. Сифон 7 снабжен краном 8, который открывают перед введением водородного электрода в гальваническую цепь. Электродный потенциал водородного электрода принят равным нулю; поэтому электродный потенциал, который требуется измерить, равен наблюдаемой ЭДС элемента Е, состоящего из испытуемого полуэлемента и водородного электрода сравнения
E = Ex - 0 = Ex .
При пользовании водородным электродом следует применять только чистый водород, следить за постоянством его давления, учитывать давление водяного пара над раствором серной кислоты и соблюдать ряд других предосторожностей. Поэтому его часто заменяют другими электродами, потенциалы которых точно измерены по сравнению с водородным. В качестве таких электродов применяют хлорсеребряный, каломельный и хингидронный электроды, отличающиеся простотой устройства и устойчивостью потенциала.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Электрохимический ряд напряжений, последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов.
Металлические электроды в водном растворе электролита образуют следующий электрохимический ряд напряжений: Li, К, Rb, Ba, Sr, Ca, Na, Се, Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au.
-Слева направо в ряду активности уменьшаются восстановительные св-ва металлов,
-металл нах-ся левее (ближе к началу) вытесняет металл стоящий правее из их солей в р-ре,
-металлы стоящие до Н2 вытесняют его из р-ра кислот( за исключением HNO3 и H2SO4конц)
2. Сильные и слабые электролиты. Степень электролитической диссоциации.
Электролит —вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит.
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации.
Степень диссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
3.1 литр кислорода весит 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния,эквивалент которого равен 12
-----------------------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 34
