К р и о г е н н а я т е х н и к а
Кафедра криогенной техники
Лось В.И.
К р и о г е н н а я т е х н и к а
конспект лекций для студентов,
Обучающихся по специальности 8.090520
"Холодильные машины и установки"
Под редакцией профессора В.А. Наера
Одесса - 2002
Составитель – Лось Валерий Иосифович
доцент кафедры криогенной техники
Рецензент – Наер Вячеслав Андреевич
доктор технических наук, профессор,
заведующий кафедрой «Криогенная техника»
Конспект лекций по дисциплине «Криогенная техника» включает темы, связанные с особенностями поведения веществ при низких температурах, методами достижения низких температур, расчётом и анализом циклов криогенных установок, а также с теоретическими основами разделения смесей. Основная цель состояла в сжатом изложении основных направлений криогенной техники для студентов, специализирующихся в области умеренного холода, но желающих составить представление об этой области низкотемпературной техники.
В конспекте излагается третье начало термодинамики и рассматриваются особенности поведения тел вблизи абсолютного нуля. При изложении раздела, посвящённого методам достижения низких температур, использован материал, обобщённый и достаточно полно изложенный в учебнике Архарова А.М., Марфениной и Микулина Е.И «Криогенные системы». Разделы, связанные с рассмотрением циклов криогенных установок и теоретических основ разделения смесей, изложены таким образом, чтобы студент получил основное представление о методах сжижения и разделения газовых смесей. Для углублённого изучения, рассматриваемых в конспекте вопросов, приведен список соответствующей литературы.
Конспект лекций по дисциплине «Криогенная техника» для студентов специальности 8.090520 «Холодильные машины и установки» рассмотрен на заседании кафедры «Криогенная техника» (протокол № 2 от 10 октября 2002 года) и утверждён методической комиссией института низкотемпературной техники.
Председатель методической комиссии
доктор технических наук, профессор Е.С.Авдеев
о г л а в л е н и е
Введение.................................................................................................................................................................................... 3
1. ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ....................................................................................................................... 3
2. МЕТОДЫ ДОСТИЖЕНИЯ НИЗКИХ ТЕМПЕРАТУР.............................................................................................. 3
2.1. ПРОЦЕССЫ, СОПРОВОЖДАЮЩИЕСЯ ПОНИЖЕНИЕМ........................................................................... 3
ТЕМПЕРАТУРЫ В АДИАБАТНЫХ УСЛОВИЯХ..................................................................................................... 3
2.2. ИЗМЕНЕНИЕ ОСНОВНЫХ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ПРИ СЖАТИИ РЕАЛЬНОГО ГАЗА 3
2.3. ДРОССЕЛИРОВАНИЕ................................................................................................................................................. 3
2.4. ПРОЦЕСС U = CONST.................................................................................................................................................. 3
2.5. РАВНОВЕСНОЕ АДИАБАТНОЕ РАСШИРЕНИЕ ГАЗА................................................................................ 3
2.6. ВЫХЛОП ИЛИ СВОБОДНЫЙ ВЫПУСК ГАЗА ИЗ БАЛЛОНА............................................................ 3
ПРОЦЕСС ВПУСКА............................................................................................................................................................... 3
2.7. ПРОЦЕССЫ В АДИАБАТНОЙ СИСТЕМЕ С ПЕРЕМЕННОЙ МАCСОЙ................................................. 3
2.8. РАСШИРЕНИЕ ГАЗА В АДИАБАТНОЙ ВИХРЕВОЙ ТРУБЕ РАНКА—ХИЛША................................ 3
2.9. ПРОЦЕССЫ ВОЛНОВОГО РАСШИРЕНИЯ ГАЗА............................................................................................ 3
2.10. ОТКАЧКА ПАРОВ КИПЯЩЕЙ ЖИДКОСТИ.................................................................................................... 3
2.11. ПРОЦЕССЫ ОХЛАЖДЕНИЯ С ИСПОЛЬЗОВАНИЕМ РАБОЧЕЙ СРЕДЫ В ТВЕРДОМ СОСТОЯНИИ 3
2.12. ПРОЦЕССЫ ОХЛАЖДЕНИЯ, ОСНОВАННЫЕ НА ИСПОЛЬЗОВАНИИ СВОЙСТВ 4He и 3He.. 3
2.13. РАЗЛИЧНЫЕ ПРОЦЕССЫ ОХЛАЖДЕНИЯ.................................................................................................... 3
3. ЦИКЛЫ КРИОГЕННЫХ УСТАНОВОК...................................................................................................................... 3
3.1. ЦИКЛ С ОДНОКРАТНЫМ ДРОССЕЛИРОВАНИЕМ....................................................................................... 3
3.2. ПОТЕРИ ХОЛОДА В ЦИКЛАХ КРИОГЕННЫХ УСТАНОВОК.................................................................. 3
3.3. ЦИКЛ С ОДНОКРАТНЫМ ДРОССЕЛИРОВАНИЕМ И.................................................................................. 3
ПРОМЕЖУТОЧНЫМ ОХЛАЖДЕНИЕМ..................................................................................................................... 3
3.4. ДЕТАНДЕРНЫЕ ЦИКЛЫ........................................................................................................................................... 3
3.5. ДЕТАНДЕРНЫЙ ЦИКЛ СРЕДНЕГО ДАВЛЕНИЯ............................................................................................ 3
3.6. ДЕТАНДЕРНЫЙ ЦИКЛ ВЫСОКОГО ДАВЛЕНИЯ.......................................................................................... 3
3.7. ДЕТАНДЕРНЫЙ ЦИКЛ НИЗКОГО ДАВЛЕНИЯ............................................................................................... 3
3.8. Газовые криогенные циклы....................................................................................................................... 3
4. Теоретические основы разделения смесей....................................................................................... 3
4.1. Термодинамические диаграммы смесей...................................................................................... 3
4.2. Теоретические основы процесса ректификации.................................................................. 3
4.3. Методы расчета процесса ректификации..................................................................................... 3
литература.............................................................................................................................................................................. 3
Введение
Криогенная техника – самая молодая отрасль холодильной техники. Развитие криогенной техники тесно связано с прогрессом новых отраслей промышленности. Интенсивное развитие криогенной техники в значительной степени обязано широкому использованию продуктов разделения воздуха, природного газа и различных газовых смесей в химической, металлургической и других отраслях промышленности.
В настоящее время в значительных масштабах используются температуры жидкого водорода ( 20,4 К). Всё большее значение приобретают температуры жидкого гелия ( 4,2 К) в практической радиотехнике, в радиоэлектронике.
Значительное количество воздухоразделительных и газоразделительных установок находится в эксплуатации. Установки такого рода отличаются большой энергоёмкостью. Поэтому серьёзное значение имеет использование методов анализа энергетической эффективности процессов и определения оптимальных режимов работы установок. Достаточное внимание в криогенной технике уделяется вопросам теплообмена и разделения, так как эти процессы, играя существенную роль в технике глубокого охлаждения, часто определяют конструктивное и аппаратурное решение всей установки.
Курс лекций содержит изложение термодинамических основ криогенной техники, достаточно подробное рассмотрение методов получения низких температур. Должное внимание уделяется расчёту и анализу теоретических и действительных циклов криогенных установок, анализу процессов разделения смесей. Основное внимание при этом уделено основному промышленному методу разделения смесей – ректификации. Изучение этого вопроса завершается рассмотрением методов расчёта числа теоретических тарелок.
ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ
Открытие третьего начала термодинамики связано с нахождением химического сродства—величины, характеризующей способность различных веществ химически реагировать другс другом. Эта величина определяется работой химических сил при реакции.
Первое и второе начала термодинамики позволяют вычислить химическое сродство только с точностью до некоторой неопределенной функции . Чтобы определить эту функцию, нужны в дополнение к обоим началам термодинамики новые опытные данные о свойствах тел. Поэтому Нернстом были предприняты широкие экспериментальные исследования поведения веществ при низкой температуре. В результате этих исследований и было сформулировано третье начало термодинамики:
по мере приближения температуры к 0 К энтропия всякой равновесной системы при изотермических процессах перестает зависеть от каких-либо термодинамических параметров состояния и в пределе (T =0 К) принимает одну и ту же для всех систем универсальную постоянную величину, которую можно принять равной нулю.
Общность этого утверждения состоит в том, что, во-первых, оно относится к любой равновесной системе и, во-вторых, что при Т 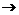 0 К энтропия не зависит от значения любого параметра системы. Таким образом, по третьему началу,
0 К энтропия не зависит от значения любого параметра системы. Таким образом, по третьему началу,
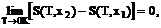 (1.1 )
(1.1 )
или
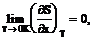 (1.2 )
(1.2 )
где х—любойтермодинамический параметр.
Предельное значение энтропии, поскольку оно одно и то же для всех систем, не имеет какого-либо физического смысла и поэтому полагается равным нулю. Как показывает статистическое рассмотрение этого вопроса, энтропия, по своему существу, определена с точностью до произвольной постоянной (подобно, например, электростатическому потенциалу системы зарядов в какой-либо точке поля). Таким образом, нет смысла вводить некую «абсолютную энтропию», как это делал Планк и некоторые другие ученые.
Постоянство энтропии (S 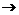 0) при Т
0) при Т  0 К, согласно (1.1), означает, что изотермический процесс T=0 К является одновременно и изоэнтропийным, а следовательно, и адиабатным. Таким образом, по третьему началу нулевая изотерма совпадает с нулевой изоэнтропой и адиабатой.
0 К, согласно (1.1), означает, что изотермический процесс T=0 К является одновременно и изоэнтропийным, а следовательно, и адиабатным. Таким образом, по третьему началу нулевая изотерма совпадает с нулевой изоэнтропой и адиабатой.
Существует ряд веществ (некоторые сплавы, глицерин, СО, NO и др.), для которых  при T
при T  0 К стремится к отличной от нуля величине.
0 К стремится к отличной от нуля величине.
Как показал тщательный анализ, это кажущееся противоречие с третьим началом связано с «замораживанием» некоторых веществ в метастабильных или неравновесных состояниях, в которых при низкой температуре эти вещества могут находиться длительное время (несколько дней или недель), прежде чем придут в стабильные равновесные состояния. Когда измерения были проведены с большими промежутками времени, то оказалось, что разность энтропии  во всех случаях исчезает при T
во всех случаях исчезает при T 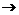 0 К.
0 К.
В настоящее время справедливость третьего начала обоснована для всех термодинамически равновесных систем.
Из третьего начала непосредственно следует недостижимость температуры 0 К.
Действительно, охлаждение системы осуществляется повторением следующих другза другом процессов адиабатного расширения (при котором понижается температура) и изотермического сжатия (при котором уменьшается энтропия). По третьему началу при изотермических процессах, когда температура приближается к 0 К, энтропия перестает изменяться при сжатии. Поэтому состояние с S=0 за конечное число указанных процессов недостижимо, а следовательно, недостижим и 0 К, так как согласно тому же началу состояние с T =0 К совпадает с состоянием S=0. К температуре 0 К можно лишь асимптотически приближаться.
Это следствие третьего начала по своему содержанию эквивалентно третьему началу, т. е. если третье начало неверно, то можно достичь температуры 0 К, и если можно достичь 0 К, то разность значений энтропии при 0 К должна быть отлична от нуля. По этой причине третьим началом термодинамики часто называют принцип недостижимости 0 К. Именно так сформулировал это начало Нернст, который не любил понятия энтропии и не употреблял его. Однако, формулировка третьего начала в виде закона о поведении энтропии при T 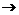 0 К более удобна, так как непосредственно приводит к лаконичной математической записи , приведенной ранее.
0 К более удобна, так как непосредственно приводит к лаконичной математической записи , приведенной ранее.
Сказанное позволяет сформулировать следующее положение:
ДРОССЕЛИРОВАНИЕ
Адиабатное расширение газа в открытой системе в условиях стационарного течения без совершения внешней работы и приращения скорости на контрольной поверхности называется дросселированием. Следует подчеркнуть, что стационарность течения предполагает в первую очередь постоянство давлений до и после дросселирования, а условие отсутствия приращения скорости течения на контрольной поверхности не исключает возможности ее местного увеличения (или уменьшения) внутри системы, например, в самом дроссельном устройстве.
Для практического осуществления этого процесса на пути газа устанавливают какое-либо гидравлическое сопротивление: дроссельный вентиль, заслонку, калиброванное отверстие и пр.
Дж. Джоуль и У. Томсон исследовали этот процесс следующим образом . По медной трубке медленно протекал установившийся поток газа (начальная температура T1), проходя через пробку, защищенную экранами. В опытах фиксировали изменения температуры при изменении перепада давлений Dр = p1 — р2.
Рассмотрим элементарный объем медленно текущего потока газа в двух сечениях, расположенных по обе стороны от пробки и достаточно удаленных от нее, где движение можно считать стационарным. Если скорости газа в рассматриваемых сечениях одинаковы, то для процесса дросселирования при l = 0 и q = 0 получим
i2=i1=const или u1 + p1v1= u2+ p2v2 = const. (2.2)
Так как никаких предположений о свойствах газов не делали, то полученный результат справедлив как для идеального, так и для реального газа: при дросселировании энтальпия газа не изменяется. Для идеального газа изменение внутренней энергии и энтальпии в любом процессе определяется выражениями du = cv dT и di = cp dT , откуда следует: если di = 0, то dT и du также равны нулю.
Для реального газа из уравнения (2.2) не следует постоянство температуры и внутренней энергии при дросселировании. При расширении реального газа увеличиваются расстояния между молекулами и совершается работа против молекулярных сил притяжения. Кроме того, в потоке реального газа работа гидродинамических сил каждой единицы массы на входе и выходе из контрольной системы, равная произведению pv, различна из-за разной сжимаемости. Эти работы предопределяют изменение внутренней энергии и температуры, поэтому в общем случае для реального газа при дросселировании
di = 0 (i = const); dT ¹о; du ¹о . (2.3)
Таким образом, температура реального газа при дросселировании может как понижаться, так и повышаться.
Процесс дросселирования необратим. Для идеального газа он необратим полностью, так как не сопровождается эффектами, которые могли бы способствовать возвращению в исходное состояние. Приращение энтропии максимально и равно убыли энтропии при изотермическом сжатии идеального газа. Процесс дросселирования реального газа частично обратим, так как сопровождается изменением температуры; при этом создается «тепловой резервуар» с температурой более высокой или более низкой и существует возможность использования перепада температур для получения работы (эту работу можно использовать для частичного возвращения газа в исходное состояние). Приращение энтропии при дросселировании реального газа не равно изменению энтропии при его изотермическом сжатии.
Определим изменение температуры реального газа при дросселировании
(¶Т /¶р)i = ai = (1/Ср) [Т (¶v/¶Т)р - v] (2.4)
Величина (¶Т/¶р)i = ai — дифференциальный эффект Джоуля—Томсона, определяющий изменение температуры при бесконечно малом падении давления в процессе дросселирования.
Практически при дросселировании всегда имеется конечная разность давлений, поэтому для такого процесса


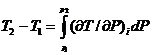 (2.5)
(2.5)


Это выражение определяет так называемый интегральный эффект Джоуля—Томсона (изменение температуры при конечной разности давлений). Интегральный эффект дросселирования определяют обычно по таблицам или диаграммам (рис. 2.2).
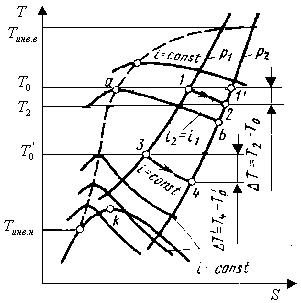 Рис.2.2. Процесс дросселирования в диаграмме Т—s
Рис.2.2. Процесс дросселирования в диаграмме Т—s
Знак эффекта дросселирования может быть различным.
Если DТ/Dp = (T2 — T1)/(p2 — p1) > 0, то Т2< T1 (охлаждение), поскольку всегда p2<p1;
если DТ/Dр < 0, то Т2> T1, что соответствует нагреванию.
Изменение знака дроссельного эффекта называют инверсией. В точке инверсии (¶T/¶p)i=0. Кривая, на которой (¶T/¶p)i=0 ,называется кривой инверсии.
Кривая инверсии разграничивает области положительного (охлаждение) и отрицательного (нагревание) дроссель-эффекта.
На рис. 2.3. приведены кривые инверсии для некоторых газов. Область под кривой инверсии соответствует положительному дроссельному эффекту.
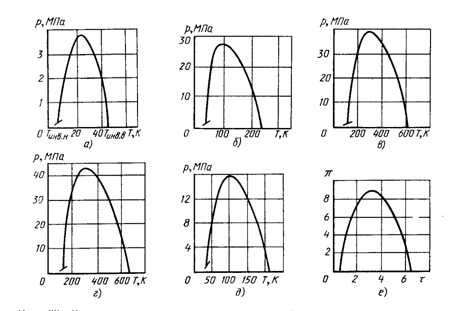
Рис. 2.3. Кривые инверсии для некоторых газов
а - гелия; б - неона; в - азота; г - воздуха; д - водорода; е - газа ван дер Ваальса
(в приведенных координатах)
Для каждого вещества существует максимальная температура инверсии Тинв.в, выше которой при любых давлениях дроссель-эффект отрицателен. Эта температура называется верхней температурой инверсии. Существует и так называемая нижняя температура инверсии Тинв.н в области жидкости.
В координатах Т — s кривая инверсии проходит через экстремальные значения изоэнтальпии (i = const) и асимптотически приближается к Тинв.в. как к температуре инверсии малых давлений. Температуры инверсии для разных газов различны.
Для некоторых газов (воздух, азот, кислород) верхняя температура инверсии выше средней температуры окружающей среды, для других (гелий, неон, водород) - ниже. Для охлаждения газа при дросселировании необходимо, прежде всего, понизить его температуру до значения ниже верхней температуры инверсии Тинв.в Если это условие выполнено, то возникает вопрос: до какого давления p1 следует сжать газ, чтобы достичь максимального интегрального эффекта DT при известной начальной температуре T0 (где То — обычно температура окружающей среды или температура предварительного охлаждения). Продифференцировав выражение для интегрального дроссель-эффекта по
р и приравняв нулю полученное выражение, найдем
(¶Т / ¶р)i. = 0. (2.6)
Это выражение является условием того, что искомая точка находится на кривой инверсии, а искомое давление равно давлению инверсии при данной температуре. Однако, в циклах с дросселированием практически (экономически) целесообразное давление сжатия может быть меньше давлений точки инверсии, например, в случае сжатия воздуха (при Т = 300 К ограничиваются давлением p » 20 МПа вместо 39 МПа). В гелиевых и водородных циклах с дросселированием оптимальные давления сжатия близки к давлениям инверсии.
При небольших давлениях значение ai, для данного газа зависит практически только от температуры. В области газообразных состояний при снижении температуры дифференциальный эффект дросселирования возрастает.
При увеличении плотности газа ai начинает зависеть от давления. Экспериментально установлено, что ai уменьшается при увеличении давления, а зависимость ai от р близка к линейной. Влияние давления на ai практически может сказываться только при сравнительно высоких давлениях .
Из изложенного ясно, что для увеличения интегрального эффекта начальную температуру процесса дросселирования следует понижать. Однако, надо четко понимать, что в низкотемпературных циклах с дросселированием холодопроизводительность теоретического цикла без потерь холода не зависит от температуры начала дросселирования (процесс дросселирования в цикле не является холодопроизводящим). Увеличение интегрального эффекта дросселирования при снижении температуры открывает лишь принципиальную возможность увеличения холодопроизводительности. Практически для этого необходимо так называемое предварительное охлаждение. Роль предварительного охлаждения сводится к созданию теплового резервуара с температурой Т'о, более низкой, чем температура окружающей среды T0. При этом в области положительного дроссель-эффекта увеличивается разность энтальпии сжатого и несжатого газов при одинаковой температуре, что и обусловливает увеличение холодопроизводительности в цикле. Эту разность энтальпии, часто используемую при инженерных расчетах, обозначают в общем случае DiT и называют изотермическим эффектом дросселирования. Значение DiT находят по таблицам или тепловым диаграммам как разность энтальпий сжатого и несжатого газов при данной температуре.
Термины «тепловой» или «изотермический эффект дросселирования» можно объяснить следующим образом. Если сравнить два состояния, соответствующие точкам 1 и 2 , то разность энтальпии i1' – i2, определяет количество теплоты, которую можно отнять у тела, находящегося при температуре окружающей среды, используя эффект снижения температуры при дросселировании. С другой стороны, DiT равна изменению энтальпии при изотермическом сжатии или расширении газа. Для того, чтобы в условиях стационарного течения расширить газ без совершения внешней работы и изменения температуры, т. е. изотермически, необходимо было бы подвести количество теплоты, равное DiT0. При положительном дроссель эффекте DiT определяет вклад компрессора в холодо-производительность цикла.
2.4. ПРОЦЕСС U = CONST
Если процесс расширения газа осуществить при тех же условиях, что и процесс дросселирования (без теплообмена с окружающими телами и без совершения внешней работы ), но в отличие от дросселирования расширять газ в закрытой системе, т. е. не в условиях стационарного течения, а в устройстве с жесткими стенками, то полная внутренняя энергия газа в такой системе будет постоянна. Это процесс расширения u= const; какого-либо характерного названия он не имеет. Схема реализации процесса u = const воспроизводит схему опыта Джоуля—Гей-Люссака (рис. 2.4).
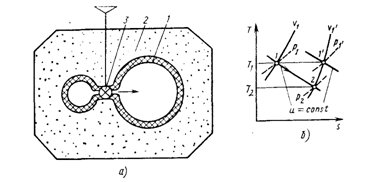
Рис.2.4. Схема реализации процесса u = const (а) и его изображение в диаграмме T—S (б)
Исследуемая система 1 состоит из двух сосудов с жесткими стенками. Сосуды контактируют один с другим и изолированы от окружающей среды слоем изоляции 2. Начальные давления газа в сосудах различные, а температуры газа одинаковые; начальное стационарное состояние с температурой T1. При помощи вентиля 3 можно выравнивать давления газа в сосудах. При выпуске газа из одного сосуда давление и температура в нем снижаются; в это время в другом сосуде при втекании в него газа давление и температура повышаются. После выравнивания давлений в течение некоторого времени происходит выравнивание температур газа, пока система не придет в стационарное состояние с температурой Т2. Изменение температуры газа в процессе u = const можно определить из уравнения
au = ( ¶T/ ¶p )u=- (¶u / ¶р)T / ( ¶u / ¶T )p (2.7)
Для идеального газа ( ¶u / ¶v )T= (¶u / ¶р)T = 0, поэтому и dT = 0 в процессе u = const. Этот результат, установленный в опытах Джоуля—Гей-Люссака при расширении газов в области малых давлений еще в 1807 г., явился доказательством фундаментального положения о том, что внутренняя энергия идеального газа есть функция только температуры и не зависит от давления (плотности).
Однако, если этот опыт провести при расширении сильно сжатых газов, то температура не будет постоянной, а снизится: T2< T1. Таким образом, в процессе u = const для любого реального газа au — всегда положительная величина, т. е. температура снижается.
Процесс u = const не имеет столь большого практического значения, как процесс дросселирования i = const, однако, приведенные соображения позволяют глубже понять сущность процессов внешне адиабатного расширения газа без совершения внешней работы в условиях открытых и закрытых систем.
ПРОЦЕСС ВПУСКА
Рассмотрим процесс внешне адиабатного расширения газа при выпуске его из какой-либо емкости (баллона, цилиндра и пр.). Такой процесс часто называют выхлопом или свободным выпуском газа. Этот процесс — один из самых распространенных. Особенно часто его используют в низкотемпературных машинах как один из рабочих процессов циклов этих машин. Схема организации процесса выхлопа весьма проста. Баллон со сжатым газом имеет выпускной клапан, после открытия которого газ быстро вытекает из баллона и направляется в трубопровод .
Процесс выхлопа является нестационарным и неравновесным адиабатным процессом расширения газа с совершением внешней работы. Теплообмен газа со стенками исключен по условию, и неравновесность обусловлена тем, что при изменении объема силы давления газа на контрольной поверхности системы не уравновешены силами противодавления. Начальные параметры газа в баллоне Тн и pH. Баллон герметично закрыт клапаном-задвижкой. После освобождения задвижка начинает двигаться без трения в выпускной трубе. Газ оказывает на задвижку давление, которое постепенно падает. С другой стороны, на задвижку действует постоянная сила противодавления, так как газ вытекает в область постоянного давления pk . Когда давление в баллоне достигнет рk , задвижка остановится. Через некоторое время после окончания процесса в результате диффузии и смешения во всех частях системы установится равновесная температура Tk , которую можно определить из выражения
TH / Tk = k / [ 1+ (pk /pH) (k – 1)]. (2.13)
Снижение температуры газа при одинаковых TH , pH , pk в неравновесном адиабатном процессе меньше, чем в изоэнтропном процессе. Следует обратить внимание на то, что при DP= (pH - pk ) ® dp соблюдаются условия квазиравновесия. В этом случае дифференциальные эффекты процесса выхлопа aB и изоэнтропного процесса практически одинаковы:
aB = (dT / dp)B = aSH = const. ( 2.14 )
Исходя из уравнение (2.14), нетрудно построить линии aB = aSH= const для процессов выхлопа в координатах Т — s при заданных TH и pH (рис. 2.6.).
|
Рис. 2.6. Линии процесса выхлопа в диаграмме T-s для воздуха
Из рисунка видно, в частности, что при использовании процесса выхлопа в качестве холодопроизводящего процесса нерациональны большие степени расширения в одной ступени. Чем меньше степень расширения, тем выше эффективность процесса выхлопа.
Если процесс выхлопа рассматривать во времени, то неизбежно приходится учитывать «температурное расслоение», или возникновение температурного градиента в потоке выходящего из баллона газа.
Впервые процесс выхлопа был использован Л. Кальете в 1877 г. для ожижения кислорода и других газов. Затем он применен Э. Ольшевским и С. Вроблевским для получения ожиженных газов. В 1932 г. Ф. Симон успешно использовал этот процесс
для ожижения гелия. В 1959 г. У. Гиффорд и Мак-Магон построили оригинальный криогенератор, в котором циклически повторялся процесс выхлопа. Процесс свободного выпуска газа использован и в так называемой пульсационной трубе. Процесс выхлопа является одним из важнейших рабочих процессов поршневых детандеров.
В заключение отметим, что обратным процессу выхлопа по физическому смыслу является процесс впуска газа в какую-либо емкость. В этом случае происходит неравновесное адиабатное сжатие газа, предварительно находившегося в баллоне. Если сжимаемый газ, находившийся в баллоне, остается изолированным от входящих порций свежего газа, то можно записать, что
Tk / TH = [ 1 + (k - 1) (pk / pH )] / k.(2.15)
При впуске газа с температурой TBx температуру Tk в баллоне после заполнения определяют с учетом смешения газа сжимаемого и вновь поступающего. Выполнив соответствующие вычисления, получим
Tk = (k TBx TH pk / pH) / [TH (pk / pH – 1) + k TBx. ] . (2.16)
Рассматривая процесс впуска во времени, необходимо также учитывать возникновение температурного градиента в потоке впускаемого газа. Температура в баллоне максимальна вдали от впускного клапана в зоне сжатия газа, находившегося перед впуском. Датчики температуры могут фиксировать кратковременно местное повышение температуры. Наиболее низкие температуры в струях газа вблизи от входного окна или клапана. При интенсивном смешении температурный градиент исчезает, и в баллоне устанавливается температура, теоретически определяемая уравнением (2.16). Неравномерное поле температур в сосуде, в который входит газ, можно в определенной конструкции стабилизировать во времени и, используя повышение температуры сжимаемого газа для передачи его энергии в окружающую среду, получить охлаждающее устройство. Это показано У. Гиффордом и Р. Лонгсвортом, осуществившими подобные процессы в пульсационной трубе .
ЦИКЛЫ КРИОГЕННЫХ УСТАНОВОК
В криогенной технике используют разнообразные циклы криогенных установок. Они
классифицируются по различным принципам. В соответствии с этим можно выделить
основные циклы криогенных установок:
1. Простые и сложные дроссельные циклы
2. Простые и сложные детандерные циклы
3. Комбинированные циклы
4. Газовые циклы
Для описания энергетических характеристик этих циклов пользуются различными величинами: холодопроизводительность, работа, холодильный коэффициент и коэффициент ожижения.
ЦИКЛ БЕЗ РЕГЕНЕРАЦИИ
Рассмотрим цикл с однократным дросселированием без регенерации, т.е. будем полагать, что дросселируется сжатый газ от температуры окружающей среды внутри кривой инверсии (при этом будет наблюдаться охлаждение). На рисунке 3.1 дано изображение рассматриваемого цикла: 1 – 2 - изотермическое сжатие; 2 – 3 - дросселирование; 3 – 1 –
изобарный нагрев. В действительности процесс 1 – 2 – это совокупность двух процессов: 1 – 2* - адиабатное сжатие и 2* - 2 – изобарное охлаждение. В реальных установках используется многоступенчатое сжатие с промежуточным охлаждением.
Для рассматриваемого цикла величина холодопроизводительности q0 записывается в виде
q0 = i1 – i2 =D iT (3.1)
Холодопроизводительность цикла с однократным дросселированием без регенерации определяется величиной интегрального изотермического дроссель-эффекта.
Из рассмотрения цикла видно, что параметры лишь двух точек 1 и 2 определяют энергетические характеристики цикла. Точка 1 чаще всего определяется параметрами окружающей среды и поэтому является как бы фиксированной. Таким образом,фактически, лишь положением точки 2 определяются энергетические характеристики цикла. Положение точки 2, в свою очередь, определяется Т окр.ср. и давлением Р2. Следовательно, лишь одна величина -давление сжатия Р2 влияет на энергетические характери
 |
стики цикла .
Рис. 3.1. Цикл с однократным дросселирование без регенерации
При заданной температуре Т окр.ср. максимальное давление, при котором холодопроизводительность цикла будет максимальной, соответствует давлению инверсии Ринв., которое определяется изобарой, проходящей через точку касания изоэнтальпы и изотермы окружающей среды. Например, для воздуха при Т окр.ср. = 300 К значение Ринв. = 400 бар. На приводимом рисунке видно, что с ростом давления сжатия Р2 холодопроизводительность цикла возрастает, если давление сжатия, разумеется, не превышает давления инверсии.
Таким образом, в рассматриваемом цикле холодопроизводительность растёт с ростом давления сжатия Р2 до тех пор, пока оно не превышает давления инверсии Ринв.
Для криогенных веществ, у которых максимальная температура инверсии меньше температуры окружающей среды (например, для гелия, неона, водорода) невозможно получить холод в цикле с однократным дросселированием, т.к. при дросселировании от температуры окружающей среды будет наблюдаться нагрев, а не охлаждение.
Если в качестве рабочего тела для этого цикла использовать идеальный газ, то холодопроизводительность q0 = 0 ( точка 3 совпадает с точкой 1). Напомним, что для идеального газа ai = 0, а следовательно, aT = 0 и DiT = 0.
Выражения для работы и холодильного коэффициента имеют вид

 (3.2 )
(3.2 )
Вместо точного выражения для работы, приведенного выше,часто используют приближенное выражение, полагая, что сжимаемый газ при температуре окружающей среды следует законам идеального газа
l = R Tокр.ср. ln (P2/P1) ( 3.3 )
Ошибка, возникающая при этом, например, для воздуха составляет около 10%, если
Р2 = 200 бар.
C ростом Р2 увеличивается холодопроизводительность q0 и работа цикла l. Вблизи кривой инверсии, однако, рост холодопроизводительности q0 замедляется . Работа цикла l c ростом Р2 увеличивается . Анализ показывает, что максимум холодильного коэффициента лежит при давлении более низком, чем давление, соответствующее максимуму холодопроизводительности. Рассмотрим влияние регенерации на энергетические характеристики цикла с однократным дросселированием.
ЦИКЛ С РЕГЕНЕРАЦИЕЙ
Рассмотрим цикл с однократным дросселированием и регенерацией (рис. 3.2). Этот цикл был первым криогенным циклом, который нашёл практическое применение в технике. Цикл с регенерацией (в виде отдельной ступени с дросселированием) является элементом большей части современных криогенных установок. Впервые цикл реализовали в 1895 г. независимо друг от друга Линде в Германии и Хэмпсон в Англии.
Рассмотрим контур, выделенный пунктиром, на рис. 3.2. Запишем энергетический баланс для выделенного контура
 |
Рис. 3.2. Цикл с однократным дросселированием и регенерацией
1 – 2 – изотермическое сжатие; 2 – 3 – изобарное охлаждение прямого потока обратным;
3 – 4 – дросселирование; 4 – 5 – процесс подвода тепла (в рефрижераторных циклах);
5 – 1 – изобарный подогрев обратного потока.
 (3.4)
(3.4)
Из полученного выражения следует, что и в цикле с регенерацией (как и в цикле без регенерации) холодопроизводительность цикла q0 определяется величиной интегрального изотермического дроссель-эффекта. Следовательно, включение регенеративного теплообменника, не изменив численно количество получаемого холода q0, понизило его температуру, т.е. сделало холод более ценным. Используя очевидное выражение для теплового баланса регенеративного теплообменника, можно привести и иную запись для холодопроизводительности цикла
 (3.5)
(3.5)
Последнее выражение, где холодопроизводительность определяется положением точек 5 и 4 рассматри

