Изменение энтропии в некоторых процессах
Во всех процессах, сопровождающихся хаотизацией структуры системы (плавление кристаллов, испарение жидкостей, расширение газов, смешение и растворение, химические реакции разложения), происходит увеличение энтропии.
В обратных им процессах (кристаллизация, конденсация паров, сжатие газов, процессы мембранного разделения, химические реакциии синтеза), где порядок расположения элементов системы возрастает, происходит уменьшение энтропии.
Рассмотрим несколько примеров расчета энтропии для типичных термодинамических систем и процессов.
В отличие от H и U можно определять абсолютные значения S для всех чистых веществ при любой температуре. Для вычисления стандартных энтропий веществ важное значение имеет третий закон (начало) термодинамики, сформулированный В. Нернстом (теорема Нернста, 1906 г.) и М. Планком (постулат Планка, 1911 г.).
Третье начало гласит, что при стремлении температуры к нулю энтропия для равновесных состояний также стремится к нулю, хотя достижение такого состояния невозможно из-за квантовой природы движения и запрещено соотношением неопределенностей Гейзенберга. Любое вещество имеет определенную положительную энтропию, но при абсолютном нуле энтропия чистых веществ, существующих в виде идеальных кристаллов, равна нулю. В соответствии с уравнением Больцмана при температуре, стремящейся к абсолютному нулю
(Т → 0 К), W = 1 (единственно возможное макросостояние – идеально правильно построенный кристалл) и S = 0. В реальных кристаллах всегда имеются дефекты структуры, поэтому значение S для них даже при 0 К должно быть больше нуля. Фактически численные значения «нулевой энтропии» S реальных кристаллов столь малы, что не мешают составить таблицы абсолютных значений стандартных энтропий веществ S0298 [Дж/мольК] (газы, жидкости, стеклообразные фазы и растворы не подчиняются третьему началу термодинамики).
Стандартные энтропии чистых веществ относят к 1 молю вещества при р = 101 кПа и Т = 298 К и обозначают S0298[Дж/моль×К]. Стандартные энтропии простых веществ положительны и не равны нулю. Стандартная энтропия образования соединения ∆fS0298 равна изменению энтропии в ходе реакции образования 1 моля соединения в стандартных условиях из простых веществ в стандартном состоянии. В ряду однотипных соединений энтропия растет по мере усложнения атомов, входящих в состав молекул, а также по мере усложнения состава молекул. Стандартные значения энтропии веществ S0298 приведены в термодинамических справочниках.
Поскольку энтропия есть функция состояния, то её изменение ∆S, сопровождающее химическую реакцию, можно рассчитать аналогично изменению энтальпии. Для химической реакции в стандартных условиях
∆S0298 (реакции) = ∑(n'S0298)прод.− ∑(n''S0298)исх.,
где n', n'' – соответствующие стехиометрические коэффициенты в уравнении реакции.
Энтропия является возрастающей функцией температуры, причем особенно резко, скачкообразно она изменяется при температурах фазовых переходов. Изменение энтропии (∆Si) при фазовых превращениях (плавление↔кристаллизация – DmH; испарение↔конденсация – DvH; полиморфные превращения кристаллов) можно рассчитать:
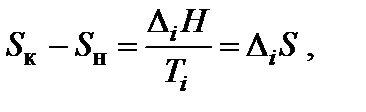
где DiH и Ti – соответственно энтальпия и температура фазового перехода.
Вообще для любого обратимого процесса при постоянных р, T, когда известна величина ∆H, изменение энтропии
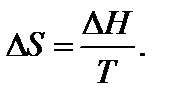
Температура является характеристикой (мерой) теплового движения молекул и атомов. Поэтому с ростом температуры растет интенсивность движения частиц и соответственно уменьшается упорядоченность системы, следовательно, возрастает энтропия:
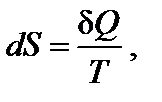
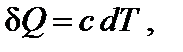
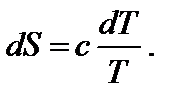
При нагревании в изобарных условиях (р = const) изменение энтропии (если есть фазовые переходы)
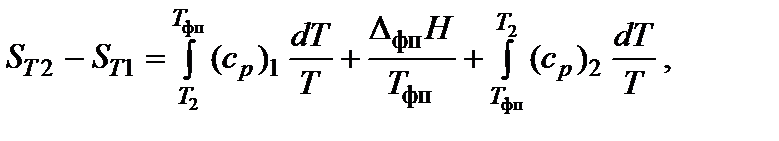
где Т1 и Т2 – температурный интервал, Тфп – температура фазового перехода, DфпH – энтальпия фазового перехода, (ср)i – изобарная теплоемкость соответствующей фазы.
3.3. Направленность самопроизвольных процессов.
Свободная энергия Гиббса
Критерием направленности самопроизвольных процессов при р, Т = const, учитывающим энтальпийную и энтропийную составляющие движущей силы процесса, является изменение термодинамической функции состояния (∆G), называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса.
Из предыдущего раздела ( 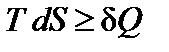 ) следует, что первое начало термодинамики можно представить в виде
) следует, что первое начало термодинамики можно представить в виде
dU + p dV – T dS £ 0,
где знак равенства относится к условию состояния термодинамического равновесия системы, а знак неравенства – к условию самопроизвольного протекания неравновесного процесса.
Рассмотримизобарно-изотермический процесс(p = const, Т = const). Поскольку dQp = dH = dU + pdV, то dH – TdS £0. При постоянной температуре d(H – T S)£0. Выражение под знаком дифференциала заменяется функцией G º H – T×S. Тогда очевидно, что условием самопроизвольного протеканияизобарно-изотермического процесса будет dG <0 (DG <0), а условием равновесия dG =0 (DG =0).
G – функция состояния системы, получившая название энергии Гиббса или изобарно-изотермического потенциала. Энергия Гиббса – часть энергии системы, которая может быть отдана ею в изобарно-изотермическом процессе в виде теплоты или работы без разрушения самой системы. Таким образом, термодинамическое условие самопроизвольного протекания реакции:
∆G <0 или ∆H – T∆S <0.
Неравенства определяют принципиальную возможность течения химической реакции при постоянных р, T. Для реального осуществления процесса необходимы не только выполнение термодинамических условий, но и учет кинетических факторов.
Процесс принципиально невозможен, если ∆G >0. Чем более отрицательно значение ∆G, тем более реакционноспособна система. Изменение энергии Гиббса отражает влияние на направление протекания процесса энтальпийного (∆Н) и энтропийного (T∆S) факторов. В зависимости от температуры влияние одного из этих факторов на значение и знак ∆G может быть определяющим.
Химические реакции можно классифицировать по возможности и условиям протекания в зависимости от характера изменения ∆Н и ∆S.
1. В изолированных системах ∆Н = 0, тогда неравенство
∆H – T ∆S <0 принимает вид − T ∆S <0. Развитие любого самопроизвольного процесса обусловлено только энтропийным фактором
∆S >0.
2. В неизолированных системах при высоких температурах критерием осуществимости процесса является изменение энтропии
(∆S >0). Энтропийный фактор влияет на направление процессов растворения кристаллических веществ, идущих с поглощением теплоты (∆Н > 0). В данном случае ∆S >> 0 и |T ∆S| >> |∆Н|, следовательно,
∆G ≈ −T ∆S и ∆G <0.
При низких температурах для реакций со значительным тепловым эффектом |∆Н| >> |T ∆S| и ∆G ≈ ∆H. Следовательно, ∆G < 0, если ∆Н < 0 (∆S > 0 или ∆S <0). При низких температурах возможность самопроизвольного протекания реакции определяется изменением энтальпии (∆Н <0).
Для большинства реакций, идущих при обычной температуре и атмосферном давлении, |∆Н |> |T ∆S|, поэтому в этих условиях эндотермические реакции (∆Н >0) редко протекают самопроизвольно в отличие от экзотермических (∆Н <0).
Изменение изобарно-изотермического потенциала в ходе химической реакции определяется следующим образом:
∆GT (реакции) = ∆HT (реакции) − T∆ST (реакции)
или, аналогично выражению для ∆H (реакции), так как G – функция состояния:
∆H0298 (реакции) = ∑(n'∆fH0298)прод − ∑(n''∆fH0298)исх
∆G(реакции)= ∑n' ∆fG(прод) – ∑n'' ∆fG(исх) .
Если значение ∆G реакции определяют в стандартных условиях, уравнение принимает вид
∆G0298(реакции) = ∑n' ∆fG0298(прод) −∑n'' ∆fG0298(исх) ,
где ∆fG0298 – стандартный изобарный потенциал образования соединения, равный изменению изобарного потенциала реакции образования 1 моля этого соединения при стандартных условиях из простых веществ в стандартном состоянии.
Эта величина выражается в килоджоулях на моль (кДж/моль). Для простых веществ ∆fG0298 = 0. Значение ∆fG0298 определяется как
∆fG0298 = ∆fH0298 − T ∆fS0298 .
Пределом убыли свободной энергии Гиббса при самопроизвольном протекании процесса является ее минимальное значение, отвечающее состоянию равновесия. Такое состояние системы наиболее устойчиво, всякое отклонение от него требует затраты энергии.
Термодинамическим условием состояния равновесия является равенство:
∆G = 0 или ∆H − T ∆S = 0 .
Пренебрегая зависимостью ∆Н и ∆S от температуры, можно приближенно определить температуру наступления химического равновесия:
Tравн = ∆H0298 /∆S0298 .
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Пример 1. Определить тепловой эффект процесса термического разложения хлорида аммония и составить термохимическое уравнение реакции.
Решение. Реакция выражается уравнением NH4Cl(к) → NH3(г) + + HCl(г). Согласно следствию из закона Гесса
∆H0298 (реакции) = ∑(n'∆fH0298)прод− ∑(n''∆fH0298)исх =
= ∆H0298(NH3)(г) + ∆H0298(HCl)(г) - ∆H0298(NH4Cl)(к).
Используя справочные данные значений ∆H0298веществ, получаем
∆H0298(реакции) = (-46,2 – 92,2) – (-314,2) = + 175 кДж.
Таким образом, термическое разложение NH4Cl является эндотермической реакцией. Термохимическое уравнение имеет вид
NH4Cl(к) → NH3(г) + HCl(г) - 175 кДж.
Пример 2. Тепловой эффект реакции С(т) + ½О2(г) = СО(г) при постоянном объеме и температуре 20º С равен 108,9 кДж. Определить тепловой эффект реакции при постоянном давлении.
Решение. Соотношение между тепловым эффектом при
V = const (QV =∆U) и тепловым эффектом при р = const (Qр =∆H) выражается уравнением ∆H = ∆U + р∆V. Определяем изменение числа молей газов в ходе реакции:
∆n = 1 - ½ = ½ (моль).
Учитывая значение Т = 293 К, R = 8,314 Дж/моль·К, а также единицы измерения величин, получаем для теплового эффекта реакции при р = const
∆H = ∆U + ∆n R T = - 108,9+1/2·8,314 /103·293 = - 107,68 кДж.
Пример 3. Возможен ли процесс получения металлического железа из оксида Fe2O3 действием водорода при стандартных условиях Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(ж)? Как скажется повышение температуры на вероятности протекания этой реакции?
Решение. Для ответа на первый вопрос задачи необходимо
рассчитать изменение свободной энергии Гиббса ∆G0298 для
рассматриваемой реакции, используя уравнение ∆GT(реакции) =
= ∆HT (реакции) − T∆SТ(реакции). Значения ∆H0298 и ∆S0298 для всех веществ, участвующих в реакции, приводятся в задании или берутся из таблиц термодинамических величин.
По следствию из закона Гесса ∆H0298(реакции) =
= ∑(n'∆fH0298)прод − ∑(n''∆fH0298)исх,найдем
∆H0298(реакции) = 3∆H0298 (H2O)(ж) – ∆H0298(Fe2O3)(к) = 3 (-285,8) – (-822,0)=
= - 857,4 + 822,0 = - 35,4 кДж.
Значение ∆H0298 (H2)(г) = 0 и ∆H0298 (Fe)(к) = 0.
Согласно
∆S0298(реакции)= ∑(n'S0298)прод − ∑(n''S0298)исх,
найдем
∆S0298(реакц) =[3S0298(H2O)(ж) + 2S0298(Fe)(к)] - [S0298 (Fe2O3)(к) +
+ 3S0298(H2)(г)] = (3·70,1 + 2·2,27) - (87,0 + 3·130,5) = - 213,8 Дж/К.
По найденным данным вычисляем
∆G0298 = ∆H0298 − T∆S0298 = - 35,4 + 213,8·10-3·298 = 28,34 кДж.
Положительное значение ∆G указывает на невозможность восстановления Fe2O3 водородом при стандартных условиях.
Ответ на второй вопрос задачи определяется знаком ∆S. Рас-
чет показал, что ∆S0298реакции < 0, следовательно, в уравнении ∆G = ∆H − T∆S величина −T∆S > 0. Повышение температуры приводит к увеличению значения ∆G, а значит, не будет способствовать протеканию реакции в прямом направлении.
Пример 4. Определить стандартный тепловой эффект реакции, если известны теплоты образования веществ.
1. Реакция образования сульфата алюминия из оксида алюминия и триоксида серы:
Al2O3 (кр) + 3SO3 (газ) = Al2(SO4)3 (кр).
| Вещество | Al2O3 (кр) | SO3 (газ) | Al2(SO4)3 (кр) |
| DfН0298, кДж/моль | –1676,1 | –395,9 | –3442,8 |
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(1×DfН0Al2(SO4)3)–(1×DfН0Al2O3 + 3×DfН0SO3 ) =
=1 (–3442,8) – [1 (–1676,1) + 3(–395,9)] = –579 [кДж].
2. Реакция взаимодействия метана и диоксида углерода с образованием оксида углерода и водорода:
CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | H2 (газ) |
| DfН0298, кДж/моль | –74,85 | –393,51 | –110,5 |
Решение. Тепловой эффект реакции определяем по следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(2×DfН0CO + 2×DfН0H2)–(1 DfН0CH4 + 1 DfН0CO2) =
=[2 (–110,5) + 2×0] – [1 (–74,85) + 1 (–393,51)] = 247,36 [кДж].
Пример 5. Определить стандартный тепловой эффект реакции, если известны стандартные теплоты сгорания веществ. Реакция взаимодействия уксусной кислоты и этилового спирта с образованием сложного эфира – этилацетата:
CH3COOH(ж) + C2H5OH(ж) = CH3COOC2H5(ж) + H2О(ж).
| Вещество | CH3COOH(ж) | C2H5OH(ж) | CH3COOC2H5(ж) | H2О(ж) |
| DcН0298, кДж/моль | –873,79 | –1366,91 | –2254,21 |
Решение. Тепловой эффект реакции определяем по следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298 =(1 DcН0ук + 1 DcН0эс)–(1 DcН0эа + 1 DcН0H2O) =
= [1 (–873,79) +1 (–1366,91)] – [1 (–2254,21)+ 1×0] = 13,51[кДж].
Пример 6. Определить изменение энтропии в стандартных условиях при протекании реакции:
CH4 (газ) + CO2 (газ) = 2CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | 2H2 (газ) |
| S0298, Дж/моль×К | 186,27 | 213,66 | 197,55 | 130,52 |
Решение. Dr S0298=(åni S0298i)продукты–(åni iS0298i)исх. вещества,
Dr S0298 = (2×197,55 + 2×130,52) – (1×186,27 + 1×213,66) = 256,21 [Дж/K].
Пример 7.Определить направление самопроизвольного протекания реакции взаимодействия оксида кальция и воды с образованием дигидроксида кальция в стандартных условиях:
CaO(кр) + H2O(ж) = Ca(OH)2(кр).
| Вещество | CaO(кр) | H2O(ж) | Ca(OH)2(кр) |
| DfG0298, кДж/моль | –603,46 | –237,23 | –897,52 |
| DfH0298, кДж/моль | –635,09 | –285,83 | –985,12 |
| S0298, Дж/моль×К | 38,07 | 69,95 | 83,39 |
Решение. Направление самопроизвольного протекания реакции определяется по изменению энергии Гиббса (DrG0 < 0).
1. Зная величины DfG0 для реагентов, можно непосредственно вычислить изменение энергии Гиббса в ходе реакции:
Dr G0298 = (å ni DfG0i)прод – (å ni DfG0i)исх. вещества,
Dr G0298 = (1(–897,52)) – [1(–603,46) + 1(–237,23)] = –56,83 (кДж).
Следовательно, данная реакция в стандартных условиях может самопроизвольно протекать в прямом направлении.
2. Изменение энергии Гиббса можно также вычислить по тепловому эффекту и энтропии реакции:
Dr G0298 = Dr Н0298 –298 Dr S 0298,
Dr Н0298 = (å ni DfН0298i)прод – (å ni DfН0298i)исх. вещества,
Dr S0298 = (åni S0298i)прод – (åni S0298i) исх. вещества,
Dr Н0298 = (1(–985,12)) – (1(–635,09) + 1(–285,83)) = –64,2 (кДж),
Dr S0298 = (1×83,39) – (1×38,07 + 1×69,95) = –24,63 (Дж/K),
Dr G0298 = –64,2 – 298(–24,63×10-3) = –56,86 (кДж).
Результаты первого и второго расчетов, естественно, совпадают (с учетом погрешности).
Пример 8. Определить возможность самопроизвольного окисления ртути кислородом в стандартных условиях (прямая реакция) и температуру, при которой возможен самопроизвольный распад окиси ртути на ртуть и кислород (обратная реакция):
Hg(ж) + ½ O2(газ) = HgO(кр).
| Вещество | Hg(ж) | O2(газ) | HgO(кр) |
| DfH0298, кДж/моль | –90,88 | ||
| S0298, Дж/моль×К | 75,90 | 205,04 | 70,29 |
Решение. Изменение энергии Гиббса в ходе реакции вычисляют по тепловому эффекту и энтропии реакции при Т=298 К:
Dr G0(Т) » Dr Н0298 – Т Dr S0298,
Dr Н0298 = (å ni DfН0298i)прод – (å ni DfН0298i)исх. вещества,
Dr S0298 = (åni S0298i)прод – (åni S0298i) исх. вещества,
Dr Н0298 = 1(–90,88) – (1×0 +½×0) = –90,88 кДж/моль,
Dr S0298 = 1×70,29 – (1×75,90 +½×205,04) = –108,13 Дж/моль×K,
Dr G0298 = –90,88 – 298(–108,13×10-3) = –58,65 кДж/моль.
Поскольку DrG0298 < 0, то окисление ртути в стандартных условиях возможно.
Самопроизвольное разложение окиси ртути на кислород и ртуть возможно, если для обратной реакции 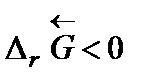 . Поскольку
. Поскольку 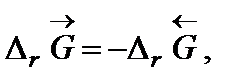 то обратная реакция по отношению к окислению возможна, если DrG0(Т) » Dr Н0 – Т Dr S 0 > 0, что выполняется при температуре выше
то обратная реакция по отношению к окислению возможна, если DrG0(Т) » Dr Н0 – Т Dr S 0 > 0, что выполняется при температуре выше 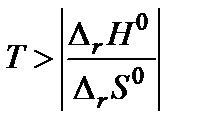 = 840,47 К.
= 840,47 К.
Библиографический список
1. Коровин, Н.В. Общая химия. М.: Высшая школа, 2000.
2. Стромберг, А.Г., Семченко Д.П. Физическая химия / Под ред. А.Г. Стромберга. М.: Высшая школа, 2001.
3. Фримантл, М. Химия в действии: В 2 ч. / Пер. с англ. М.: Мир, 1991.
4. Киселев, А.П., Крашенинников А.А. Основы общей химии: учебное
пособие / Балт. гос. техн. ун-т. СПб., 2012.
5. Кудряшов, И.В., Каретников Г.С. Сборник примеров и задач по физической химии: учебное пособие. М.: Высшая школа, 1991.
О Г Л А В Л Е Н И Е
1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.. 3
1.1. Энергия. 3
2. ПЕРВЫЙ ЗАКОН (НАЧАЛО) ТЕРМОДИНАМИКИ.. 6
2.1. Термодинамическая функция энтальпия. 7
2.2. Тепловой эффект реакции. 8
2.3. Закон Гесса. Термохимические расчеты.. 9
2.4. Зависимость теплового эффекта реакции от температуры.. 10
3. ВТОРОЙ ЗАКОН (НАЧАЛО) ТЕРМОДИНАМИКИ.. 11
3.1. Понятие энтропии. 12
3.2. Изменение энтропии в некоторых процессах. 14
3.3. Направленность самопроизвольных процессов. Свободная энергия Гиббса 16
4. ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ.. 19
Библиографический список. 23
Барунин Анатолий Анатольевич, Маслобоев Дмитрий Степанович
Термодинамические расчеты
Редактор Г.М. Звягина
Корректор Л.А. Петрова
Подписано в печать 19.02.2016. Формат 60х84/16. Бумага документная.
Печать трафаретная. Усл. печ. л. 1,5. Тираж 200 экз. Заказ № 45.
Балтийский государственный технический университет
Типография БГТУ
190005, С.-Петербург, 1-я Красноармейская ул., д.1
