Синтез соляной кислоты
Функции соляной кислоты
· денатурация белков пищи,
· бактерицидное действие,
· высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания,
· превращение неактивного пепсиногена в активный пепсин,
· снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
· после перехода в 12-перстную кишку – стимуляция секреции панкреатического сока.
Пепсин
Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивногопроферментапепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
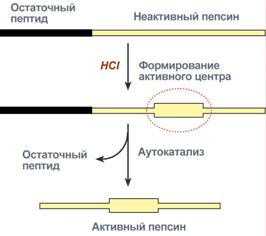
Превращение пепсиногена в пепсин
Оптимум рН для пепсина 1,5-2,0. Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматическихаминокислот (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д..
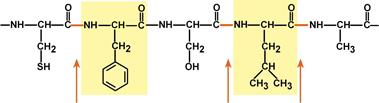
Связи, расщепляемые пепсином
Гастриксин
Его оптимум рН соответствует 3,2-3,5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазойи гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
В тонком кишечнике белки должны полностью расщепляться
Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи.
Сок поджелудочной железы содержит проферменты– трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы, соответственно, способомограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков.
В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.
Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы.
Регуляция кишечного пищеварения
В кишечнике под влиянием соляной кислоты, поступающей из желудка в составе пищевого комка, начинается секреция гормона секретина, который с током крови достигает поджелудочной железы и стимулирует выделение жидкой части панкреатического сока, богатого карбонат-ионами (HCO3–). В результате рН химуса повышается до 7,0-7,5.
Благодаря работе желудочных ферментов в химусе имеется некоторое количество аминокислот, вызывающих освобождение холецистокинина-панкреозимина. Он стимулирует секрецию другой, богатой проферментами, части поджелудочного сока, и секрецию желчи.
Нейтрализация кислого химуса в двенадцатиперстной кишке происходит также при участиижелчи. Формирование желчи (холерез) идет непрерывно, не прекращаясь даже при голодании.
Трипсин
Синтезируемый в поджелудочной железе трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина.
Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групплизинаи аргинина. Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу.
Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз триацилглицеролов.
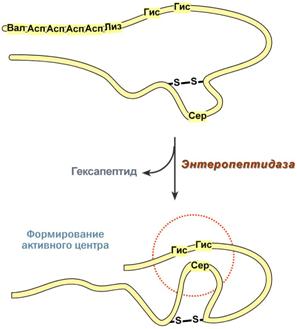 Механизм активации трипсина Механизм активации трипсина | 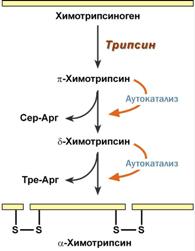 Механизм активации химотрипсина Механизм активации химотрипсина |
Химотрипсин
Образуется из химотрипсиногена при участии трипсина и промежуточных, уже активных, форм химотрипсина, которые выстригают два дипептида из цепи профермента. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей.
Фермент специфичен к пептидным связям, образованным с участием карбоксильных группфенилаланина, тирозинаи триптофана, т.е. так же, как пепсин.
Эластаза
Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Карбоксипептидазы
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы Аотщепляют с С-конца остатки алифатическихиароматическихаминокислот, карбоксипептидазы В – остатки лизинаи аргинина.
Аминопептидазы
Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидазаи лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы
Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Лизосомы энтероцитов
Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами.
При заболеваниях ЖКТ и нарушении переваривания, при диете с избытком белков часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами – развивается гниение белков в кишечнике.
В действительности же дела с перевариванием белков в ЖКТ обстоят не совсем так как в теории: постепенно в фармакологии накапливаются факты об эффективности пептидных лекарственных препаратов при их пероральном применении. Однако делать определенные выводы никто не спешит.
У детей свои причуды
