P. Dekukas, E. S. Lander, T. J. Hudson. 1996. Agene 1 страница
map of the human genome. Science 274:540—546.
Taylor K., N. Hornigold, D. Conway, D. Williams, Z. Ulinowski, M. Agoehiya, P. Fattorini, P. De Jong, P. F. R. Little, J. Wolfe. 1996. Mapping the human Y chromosome by fingerprinting cosmid clones. Genome Res. 6: 235—248.
Terwilliger J. D., J. Ott. 1994. Handbook of Human Genetic Linkage. Johns Hopkins University Press, Baltimore, Md.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое независимое наследование аллелей?
2. Нарисуйте родословную, включающую четыре поколения, у членов которой встречается заболевание, имеющее аутосомно-доминантный тип наследования. Пенетрантность заболевания составляет 70%. Что такое пенетрантностъ? Как неполная пенетрантность влияет на изучение генетических заболеваний человека?
3. Что такое лод-балл? Как он определяется?
4. Что такое генетический полиморфизм? Почему полиморфные локусы важны для картирования генов заболеваний человека?
5. Как с помощью STRP-зондов можно локализовать ген заболевания человека?
6. Что такое банк СЕРН-семей? Как он «работает»?
7. Что такое STS? Как определяют хромосомную локализацию STS?
8. Что такое контиг? Опишите подробно, как строится контиг хромосомы.
9. Как установить, что вставка геномного клона содержит кодирующую область гена?
10. Каково теоретическое обоснование позиционно-кандидатного картирования гена?
ГЛАВА 2l.
Генная терапия
Долгое время медицинская генетика занималась одной проблемой: установлением генетических основ наследственных заболеваний человека. Были разработаны диагностические тесты для выявления ряда таких заболеваний у новорожденных или плода, и по их результатам проводилось генетическое консультирование семей, относящихся к группе риска. Это позволяло подготовить консультируемых к возможности проявления данного заболевания у их потомков. Кроме того, иногда удавалось смягчить негативные последствия генетического дефекта с помощью медикаментозной терапии, переливания крови или назначения диеты.
Нормальная работа организма обеспечивается функциями множества взаимосвязанных генов, и мутация даже в одном из них может иметь самые разные последствия. Так, мутация, в результате которой изменяется активность того или иного фермента, может приводить к накоплению токсичного субстрата или дефициту соединения, необходимого для нормального функционирования клетки, а мутация в гене, кодирующем структурный белок, — к серьезным нарушениям на уровне клеток, тканей или органов. Кроме того, мутация в гене, экспрессирующемся в одной ткани, может сказаться самым серьезным образом на совсем другой ткани и привести к появлению множества симптомов. Например, мутация в гене печеночного фермента фенилаланиндегидроксилазы, в результате которой блокируется превращение фенилаланина в тирозин, оказывает серьезное влияние на нервную систему. У индивидуума, гомозиготного по дефектному гену, этот фермент не вырабатывается вообще или вырабатывается в очень небольших количествах; это приводит к повышению уровня эндогенного фенилаланина в крови, к неправильному формированию миелиновой оболочки вокруг аксонов нервных клеток центральной нервной системы и как следствие — к тяжелой умственной отсталости. Это врожденное заболевание, называемое фенилкетонурией, встречается у европеоидов с частотой 1 на 10 000 новорожденных. В каждой ткани организма экспрессируется свой набор из всей совокупности генов, но есть мутации, которые приводят к болезням, затрагивающим буквально все органы и ткани: мышцы, глаза, печень, кости, почки, сердце, нервную систему, кожу, мозг, желудок, кишечник, систему кроветворения.
Конечной целью медико-генетических исследований является создание методов лечения всех наследственных заболеваний. В табл. 21.1 перечислены продукты некоторых генов, коротко описаны симптомы заболеваний, которые обусловливаются мутациями в этих генах, указаны способы их лечения. Наследственные заболевания имеют сложные клинические проявления, и их лечение носит во многом симптоматический характер. Некоторые нарушения метаболизма корректируют назначением специальной диеты, что приводит к снижению уровня токсичных веществ в организме, накопление которых обусловливается мутациями в определенных генах. Так, при фенилкетонурии, которую выявляют у новорожденных с помощью специфического биохимического анализа крови, назначают безаланиновую диету. Для облегчения симптомов наследственных заболеваний, связанных с дефектом определенного белка, вводят внутривенно его функциональную форму, не вызывающую иммунной реакции. Такую «заместительную» терапию используют, например, для лечения гемофилии, тяжелого комбиниро-
484ГЛАВА 21
| Таблица 21.1. Применяемые в настоящее время методы лечения некоторых моногенных заболеваний человека | ||||
| Генный продукт | Заболевание и его симптомы | Частота встречаемости | Лечение | Прогноз |
| Аденозиндезаминаза | Тяжелый комбинированный иммунодефицит (SCID) Утрата Т- и В-лимфоцитов | 1:1 000000 | Трансплантация костного мозга; введение аденозиндезaминазы | Без лечения: летальный исход к двум годам С лечением: улучшение состояния пациента |
| Рецептор липопротеинов низкой плотности | Семейная гиперхолестеролемия Повышенный уровень холестерола в крови, ишемическая болезнь сердца | 1:500 (гетерозиготы) | Диета, медикаментозное лечение трансплантация печени | Улучшение состояния пациента |
| Глюкоцереброзидаза | Болезнь Гоше Накопление гл юкоиереброзидов в макрофагах, приводящее к поражению печени, селезенки и костей | 1:2 500 (среди евреев); редко у неевреев | Симптоматическое лечение: удаление селезенки, введение антибиотиков, лечение поражений костей, трансплантация костного мозга, введение глюкоцереброзидазы | Улучшение состояния пациента |
| Фактор VIII системы свертывания крови | Гемофилия Λ Изменение фактора VIII, приводившее к нарушению свертываемости крови, хронические кровоизлияния в суставы; обширные кровотечения при травмах | 1:10000 (у мужчин) | Повышение концентрации фактора VIII с помошью переливания плазмы | Увеличение продолжительности жизни при постоянном лечении; при переливании есть риск вирусной инфекции |
| Фенилаланин-гидроксилаза | Фенилкетонурия Избыток фенилаланина в крови новорожденных, умственная отсталость | 1: 10000 | Диета, исключающая фенилаланин | При ранней диагностике и непрерывном лечении — обычно благоприятный |
| α1 - Антитрипсин | Эмфизема Дефицит ингибитора сывороточных протеаз, поражение легких, цирроз печени | 1:3500 | Заместительная терапия; снижение экологических факторов риска | Заболевание прогрессирует медленнее |
ванного иммунодефицита (SCID, от англ, severe combined immunodeficiency) и болезни Гоше. Иногда для компенсации каких-то утраченных функций проводят трансплантацию костного мозга или других органов. К сожалению, нередко интенсивное лечение многих наследственных болезней начинают проводить только тогда, когда пациент находится в критическом состоянии и удается лишь ненамного продлить его жизнь. Поскольку генетические заболевания часто носят системный характер и постепенно приводят к ослаблению организма, разработка эффективных методов лечения представляет собой непростую задачу. Существующая терапия, как правило, малоэффективна, лишь немногие пациенты доживают до старости и могут иметь детей. В большинстве случаев лечение необходимо проводить многократно, оно очень дорогое и длительное. Поэтому разработка новых видов терапии очень актуальна.
После того как были установлены молекулярные основы трансформации бактерий (переноса генов из одного штамма в другой), у ученых появилась надежда, что аналогичный механизм — введение нормальных генов в дефектные соматические клетки — можно будет использовать для лечения наследственных заболеваний человека. Перспективы генной коррекции соматических клеток стали более реальными в 1980-х гг.; к этому времени были
Генная терапия 485
| Таблица 21.1. (Продолжение) | ||||
| Генный продукт | Заболевание и его симптомы | Частота встречаемости | Лечение | Прогноз |
| Трансмембранный белок, нарушения в котором приводят к муковисцидозу | Myковисцидоз Системное поражение органов, в ряде случаев недостаточность поджелудочной железы, закупорка кишечника, закупорка бронхов | 1:2500 (европеоиды) | Введение антибиотиков, физикальная очистка легких, общеукрепляющая диета | Летальный исход в возрасте до 20 лет |
| Орнитин- транскарбамилаза | Гипераммониемия Нарушение цикла мочевины, накопление аммония, дефицит аргинина Ранняя форма, развивающаяся в первые 72 ч после рождения: летаргия, рвота, кома, смерть; в случае выживания — необратимое повреждение мозга Поздняя форма; рвота, летаргия, эпилептические припадки | 1:40 000 | Диета с ограничением белка, диета, обогащенная аргинином, лекарственные Средства, трансплантация печени | Поздняя форма; благоприятный Ранняя (тяжелая) форма: снижение тяжести симптомов |
| Дистрофин | Мышечная дистрофия Дюшенна Πрогрессирующая слабость мышц | 1:7 500 (у мужчин) | Только поддерживающее лечение; полноценное питание, помощь в функционировании дыхательной системы, передвижение в инвалидной коляске | Летальный исход к 20 годам |
| β-Глобин | Серповидноклеточная анемия Хроническая анемия, системное поражение органов, селезенки, сердца, почек, печени, мозга; у гетерозиготных носителей наблюдается мягкая форма болезни | 1:500 (для гетерозигот в популяциях афроамериканцев ; в других популяциях — реже) | Переливание крови, медикаментозная терапия, анальгетики, трансплантация костного мозга | Снижение тяжести симптомов; эффективное лечение отсутствует |
разработаны методы получения изолированных генов, созданы эукариотические экспрессирующие векторы, стали рутинными эксперименты по переносу генов на мышах. В 1990 г. была предпринята первая попытка применения генотерапии для лечения SC1D (табл. 21.1) у двух девочек. Использовался следующий подход. Клонированную кДНК аденозиндезаминазы (АДА) ввели в лимфоциты, полученные от каждой из пациенток. Модифицированные клетки, синтезирующие АДА, культивировали и в течение двух лет с определенной периодичностью вводили девочкам. Через четыре года после начала лечения у обеих пациенток наблюдалась экспрессия гена АДА и отмечалось облегчение симптомов SCID. Однако истинная причина улучшения осталась не совсем ясной: был ли это эффект заместительной терапии (внутривенного введения защищенной формы АДА - полиэтиленгликоль-АДА) или собственно генной терапии. Беспорно одно: этот опыт показал безопасность генной терапии. Сходные результаты были получены и для других пациентов с SCID, одновременно получавших оба вида лечения. Исследования были продолжены на большем числе больных.
В соответствии с законодательством США, прежде чем новый лекарственный препарат будет разрешен к применению, он должен пройти четыре строго оговоренных стадии проверки.
486 ГЛАВА 21
1. Доклинические испытания, которые включают многочисленные эксперименты, проводимые in vitro и на лабораторных животных.
2. I фаза клинических испытаний проводится на небольшом числе (от 6 до 10) пациентов и часто имеет целью проверку безопасности препарата.
3. II фаза клинических испытаний проводится на большем числе пациентов и имеет целью проверку эффективности действия препарата.
4. III фаза клинических испытаний проводится с привлечением большого числа испытуемых и включает исчерпывающий анализ надежности и эффективности препарата, при этом используется информация, полученная на предыдущих этапах.
Прежде чем начать проверку препарата, необходимо, чтобы протокол его испытаний был одобрен и утвержден в соответствующих контролирующих инстанциях. С 1990 по 1992 г. было одобрено более десяти протоколов испытаний по генной терапии, находящихся в I фазе, а к 1997 г. — более 200 протоколов испытаний по генной терапии разных видов злокачественных новообразований, гемофилии, СПИДа, муковисцидоза, гиперхолестеролемии, бокового амиотрофического склероза и др. (табл. 21.2). Прежде чем приступать к I фазе клинических испытаний, необходимо учесть ряд важных моментов: предполагаемое исследование должно быть направлено на разработку методов лечения однозначно диагностируемой болезни, соответствовать существующим правилам проведения медико-биологических экспериментов и осуществляться с минимальным для пациента риском. Поскольку генная терапия представляет собой новое направление, а заболевания, которые предполагают лечить с ее помощью, столь различны, рассматривают множество разных подходов. В настоящее время все исследования по генной терапии направлены на коррекцию генетических дефектов соматических, а не половых (зародышевых) клеток. Это объясняется этическими и чисто техническими причинами, а так-
| Таблица 21.2. Некоторые заболевания, генная терапия которых проходит испытания с 1990 г. | ||
| Заболевание | Генотерапевтический препарат | Клетки-мишени |
| Тяжелый комбинированный иммунодефицит | Аденозиндезаминаза | Лимфоциты, клетки костного мозга |
| Меланома | Фактор некроза опухоли | Инфильтрирующие опухоль лимфоциты, аутологичные клетки опухоли |
| Меланома, глиобластома, рак почки | Интерлейкин-2 | Аутологичные клетки опухоли, клетки опухоли |
| Гемофилия В | Фактор IX | Аутологичные фибробласты кожи |
| Гигтерхолестеролемия | Рецептор липопротеинов низкой плотности | Аутологичные гепатоциты |
| Меланома, рак толстой и прямой кишки, рак почки | Антиген гистосовместимости HLA-B7 u β2- микроглобулин | Клетки опухоли |
| Глиобластома, СПИД, рак яичников | Тимидинкиназа вируса простого герпеса | Клетки опухоли, Т-лимфоциты |
| Муковисцидоз | Трансмембранный белок, нарушения в котором приводят к муковисцидоэу | Эпителий носовой полости и дыхательных путей |
| Рак молочной железы | Фактор типа 1 множественной устойчивости к лекарственным препаратам | CD34+- клетки крови |
| Меланома | Гранулоцитарный колониестимупируюший фактор | Клетки опухоли |
| Артрит | Антагонист рецептора интерлейкина-1 | Аутологичные фибробласты |
| Боковой амиотрофический склероз | Цилиарный нейротрофический фактор (CNTF) человека | Инкапсулированные трансдуцированные экзогенные клетки |
| Плоскоклеточный рак головы и шеи | p53 | Клетки опухоли |
| Анемия Фанкони | Фактор анемии Фанкони группы С | Клетки головного мозга |
Генная терапия 487
же соображениями безопасности: ведь ДНК, введенная в половые клетки человека, передавалась бы последующим поколениям.
В самом общем смысле под генной терапией соматических клеток человека понимают коррекцию специфического наследственного заболевания путем введения в клетку-мишень функционального экспрессирующегося гена. Однако за этим простым определением скрывается целый ряд проблем. Например, как получить доступ к клеткам, предназначенным для коррекции? Как осуществить доставку терапевтического гена? Какая доля клеток-мишеней должна получить такой ген, чтобы болезнь отступила? Необходим ли точный контроль транскрипции введенного гена для обеспечения ее эффективности? Не вызовет ли избыточная экспрессия введенного гена побочных эффектов? Будут ли модифицированные клетки поддерживаться бесконечно или потребуются повторные введения?
Хотя генная терапия соматических клеток делает только свои первые шаги, на ряд вопросов, касающихся некоторых наследственных заболеваний, уже получены ответы. Появляются все новые подходы к генной терапии соматических клеток, которые можно разделить на две большие категории: генная терапия in vivo и ex
| Рис. 21.1. Схематическое представление генной терапии ex vivo. Процедура включает: 1) получение от пациента клеток с генным дефектом; 2) культивирование изолированных клеток; 3) трансфекцию «терапевтической» генной конструкции в изолированные клетки; 4) отбор, выращивание и тестирование трансфицированных клеток; 5) трансплантацию или трансфузию трансфицированных клеток пациенту. | 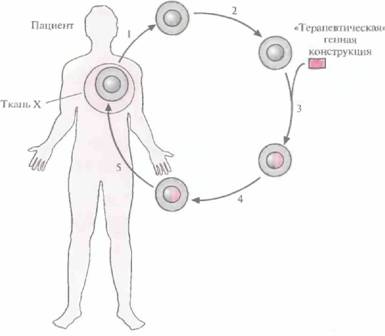 |
vivo. Разрабатывают и специфические лекарственные препараты на основе нуклеиновых кислот: антисмысловые олигонуклеотиды; РНК-ферменты, модифицированные с помощью генной инженерии; олигонуклеотиды, корректирующие генные мутации in vivo.
Генная терапия ex vivo
Генная терапия ex vivo, как правило, включает следующие этапы (рис. 21.1).
1. Получение клеток от больного.
2. Исправление генетического дефекта с помощью переноса нужного гена в изолированные клетки.
3. Отбор и наращивание генетически «исправленных» клеток.
4. Инфузия или трансплантация этих клеток пациенту.
Использование собственных клеток пациента (аутологичных клеток) гарантирует, что после инфузии или трансплантации у него не разовьется иммунный ответ.
Необходимо, чтобы процедура переноса генов, используемая для генной терапии ex vivo,
488ГЛАВА 2]
была эффективной, а «терапевтический» ген стабильно поддерживался и непрерывно экспрессировался. Этим условиям отвечают векторы, полученные на основе мышиных ретровирусов. Но ретровирусы имеют существенный недостаток — они могут приводить к злокачественной транформации клеток. Такую вероятность необходимо уменьшить, а лучше полностью исключить.
Геном ретровируса дикого типа представлен двумя идентичными одноцепочечными молекулами РНК, каждая из которых состоит из шести участков: длинного концевого повтора (5'-LTR, от англ, long terminal repeat); некодирующей последовательности пси+ (ψ+), необходимой для упаковки РНК в вирусную частицу; трех генов, кодирующих структурный белок внутреннего капсида (gag), белок, обладающий функциями обратной транскриптазы и интегразы (pol), и белок оболочки (env); 3'-LTR-последовательности (рис. 21.2). Жизненный цикл ретровируса включает следующие стадии.
1. Инфицирование клетки-мишени.
2. Синтез ДНК-копии генома с помощью собственной обратной транскриптазы,
3. Транспорт вирусной ДНК в ядро.
4. Встраивание вирусной ДНК в один из хромосомных сайтов клетки-хозяина.
5. Транскрипцию мРНК с вирусной ДНК под контролем сильного промотора, локализованного в 5'-LTR.
6. Трансляцию белков Gag, Pol и Env в цитоплазме.
7. Образование вирусного капсида и упаковку в него двух РНК-цепей и молекул обратной транскриптазы.
8. Высвобождение вирионов из клетки.
Для получения ретровирусного вектора полноразмерную ДНК ретровируса встраивают в плазмиду, с помощью эндонуклеазного расщепления удаляют большую часть гена gag и гены pol и env, оставляя 5'-концевой участок гена gag и 5'- и 3’-LTR, а затем рядом с ψ+-областью встраивают «терапевтический» ген, транскрипция которого будет контролироваться 5'-LTR-промо-тором; при необходимости можно встроить и маркерный селективный ген с собственным промотором (рис. 21.3). Такая конструкция позволяет экспрессировать оба клонированных гена. На основе этой схемы созданы различные ретровирусные векторы. Максимальный размер ДНК-вставки, которую может переносить ретровирусный вектор, — примерно 8 т. п. н.
ДНК ретровирусного вектора можно использовать для трансформации клеток саму по себе, но эффективность доставки ее в ядро и интеграции в геном клетки-хозяина крайне низка. Поэ-
 | |
| Рис. 21.2. Генетическая карта типичного ретровируса. ψ+ — последовательность, ответственная за упаковку, gag, pol и env — области, кодирующие соответственно белок капсида, белок, обладающий активностью обратной транскриптазы и интегразы, и белок оболочки. 5'-LTR содержит сигналы инициации транскрипции, причем весь геном транскрибируется как одна молекула РНК. 3'-LTR содержит сигнал полиаденилирования. | |
 | |
| Рис. 21.3. Генетическая карта ретровирусного вектора, несущего два гена. Транскрипция «терапевтического» гена (Ген X) контролируется 5'-LTR-промотором, транскрипция селективного маркерного гена (Neor) — внутренним промотором (р), 3'-LTR содержит сигнал полиаденилирования. ψ+ — последовательность, ответственная за упаковку. |
Генная терапия 489
тому была разработана методика упаковки полноразмерной РНК ретровирусного вектора в интактные вирусные частицы, с высокой частотой проникающие в клетку, что гарантирует встраивание соответствующей ей ДНК в геном клетки -хозяина. Для этого с помощью генной инженерии была создана «пакующая» клеточная линия, в одном из участков генома которой содержится ∆ψ+-сегмент 5'-LTR-gag-3'-LTR (т. е. сегмент, лишенный функциональной ψ+-последовательности), а в другом — ∆ψ+-сегмент 5'-LTR-pol-env-3'-LTR. Оба этих сегмента транскрибируются, но из-за отсутствия ψ+-последовательности и образования вирусных молекул РНК меньшего, чем в норме, размера формируются пустые вирусные частицы. При трансфекиии ДНК ретровирусного вектора в такие клетки она встраивается в хромосомную ДНК и транскрибируется с образованием полноразмерной РНК ретровируса, содержащей ψ+-последовательность. В таких условиях в вирусные капсиды упаковывается только РНК вектора. Образующиеся интактные вирусные частицы можно использовать для высокоэффективной доставки ретровирусного вектора в клетки-мишени (рис. 21.4).
В «пакующей» клеточной линии не образуются компетентные по репликации ретровирусы дикого типа, способные встраиваться в гены и приводить к некотролируемой пролиферации некоторых клеток (т. е. к превращению их в раковые клетки). Это весьма существенно, особенно если частицы ретровирусного вектора предполагается использовать для генной терапии соматических клеток человека. В качестве меры предосторожности все же проводят регулярное тестирование готовых ретровирусных векторов, с тем чтобы выявить ретровирусы дикого типа. Кроме того, в «пакующей" клеточной линии нуклеотидные последовательности ретровируса и вектора локализованы в трех разных областях хромосомы, что делает весьма маловероятной возможность последовательных рекомбинационных событий, которые могли бы привести к образованию компетентного по репликации ретровируса.
Ретровирусы активно инфицируют реплицирующиеся клетки. Для переноса генов в интенсивно растущие клетки-мишени последние обрабатывают очищенными частицами упакованного ретровирусного вектора либо проводят их совместное культивирование с производящей его клеточной линией, а затем осуществляют дифференциальную селекцию для разделения клеток-мишеней и «пакующих» клеток. Трансдуцированные клетки-мишени (те, в которые при помощи вируса была перенесена невирусная ДНК) тестируют, чтобы удостовериться, что: I ) в них синтезируется продукт терапевтического гена; 2) не образуются компетентные по репликации ретровирусы; 3) ДНК ретровирусного вектора не встроилась в сайт, изменяющий способность клеток к росту либо препятствующий их нормальному функционированию. После тестирования трансдуцированные клетки наращивают в больших количествах и с разными интервалами вводят пациенту.
Наиболее вероятными кандидатами для проведения генной терапии ex vivo (рис. 21.5) являются пациенты с наследственными заболеваниями, для лечения которых применяют трансплантацию костного мозга. Терапевтический эффект трансплантации костного мозга в отношении целого ряда болезней связан с наличием в нем тотипотентных эмбриональных стволовых клеток, которые встречаются с частотой 10~4—10~5, могут пролиферировать и дифференцироваться в различные типы клеток, такие как В- и Т-лимфоциты (B-клетки и Т-клетки), макрофаги, эритроциты, тромбоциты и остеокласты. Например, в том случае, когда генная мутация нарушает функции макрофагов, трансплантация костного мозга обеспечивает реципиенту постоянный запас компетентных макрофагов, происходящих из популяции тотипотентных стволовых клеток.
Генноинженерная модификация тотипотентных стволовых клеток с их последующей инфузией или трансплантацией пациенту для замещения утраченного типа клеток или генного продукта может стать основным способом генной терапии ex vivo. В качестве примера можно рассмотреть дефект АДА, приводящий к повышению в крови уровня аденозина и дезоксиаденозина, токсическое действие которых приводит к гибели В- и Т-лимфоцитов и развитию тяжелого иммунодефицита. Поскольку и В-, и Т-лимфоциты происходят из тотипотентных стволовых клеток, перенос в последние функционального гена АДА с последующим введением
490 ГЛАВА 21
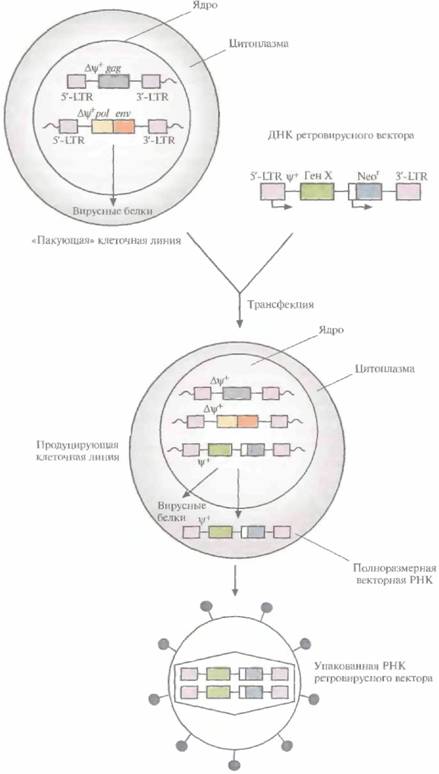 | Рис. 21.4. Получение упакованного ретровирусного вектора. В двух разных участках хромосом «пакующей» клеточной линии содержатся ретровирусные гены: в одном — gag, в другом — pol и env. Их транскрипция контролируется 5'-LTR-промотором; оба участка лишены последовательности, необходимой для упаковки (Δψ+). «Пакующая» линия клеток синтезирует вирусные белки, но из-за отсутствия в любой из ретровирусных мРНК последовательности, ответственной за упаковку, образуются пустые вирусные капсиды. После трансфекции «пакующей» линии клеток ретровирусным вектором, содержащим необходимую для упаковки последовательность (ψ+), его полноразмерные РНК транскрибируются и упаковываются в капсиды. Высвобождаемые вирусные частицы не способны реплицироваться и в данном случае содержат «терапевтический» ген (Ген X) и селективный маркерный ген (Neor). |
Генная терапия 491
| АДА-зависимый тяжелый комбинированный иммунодефицит |
| Адренолейкодистрофия |
| Синдром Чедиака— Хигаси |
| Хронический гранулематоз |
| Анемия Фанкони |
| Болезнь Гоше |
| Дефицит gpL-115 |
| Дефицит актина в гранулоцитах |
| Болезнь Хантера |
| Синдром Гурлера |
| Агранулоцитоз новорожденных (детский агранулоцитоз) |
| Болезнь Марото-Лами (мукополисахаридоз VI типа) |
| Метахроматическая лейкодистрофия |
| АДА-независимый тяжелый комбинированный иммунодефицит |
| Остеопороз |
| Дефицит пуринфосфорилазы |
| Ретикулярная дисплазия |
| Синдром Санфилиппо |
| Серповидноклеточная анемия |
| Талассемия |
| Синдром Вискотта— Олдрича |
| Х-сцепленная агаммаглобулинемия |
| Рис, 21.5. Наследственные заболевания, для лечения которых применяют трансплантацию костного мозга. |
их пациенту способствует понижению в крови уровней аденозина и дезоксиаденозина и предотвращает разрушение В- и Т-лимфоцитов. Стволовые клетки можно получить от самого пациента (оптимальный вариант) или от совместимых доноров, которых обычно нелегко найти.
К сожалению, тотипотентные стволовые клетки очень трудно выделять из костного мозга и культивировать. Исследования по ех vivo-генной терапии SCID, вызванного дефицитом АДА, проводили на аутологичных Т-клетках, модифицированных с помощью ретровирусных векторов. Т-лимфоциты имеют ограниченное время жизни, поэтому необходимо проводить их повторные инфузии. В первом испытании двум девочкам вливали с интервалом в несколько месяцев собственные генетически «исправленные» Т-клетки, продуцирующие АДА. Наблюдаемый положительный эффект, возможно, объяснялся снижением уровня аденозина и дезоксиаденозина в крови и предотвращением гибели В- и Т-клеток.
Т-клетки — не оптимальная система доставки, применяемая при генной терапии заболеваний гемопоэтических (происходящих из костного мозга) клеток. Предпочтительнее (хотя это не всегда возможно) использовать пуповинную кровь, содержащую стволовые клетки. Так, при однократном введении новорожденным с дефицитом АДА СО34+-клеток, полученных из их пуповинной крови и трансдуцированных кДНК АДА, эта кДНК поддерживалась и экспрессировалась в клетках крови неэритроидного ряда как минимум 18 мес.
