Депонирование амилоидного b-протеина имеет отношение к патогенезу болезни Альцгеймера
Болезнь Альцгеймера относится к неизлечимым нейропсихическим заболеваниям, при которых наряду с нарушением поведенческих реакций наблюдается расстройство функций сознания. Встречается оно довольно часто и является наиболее известной причиной деменции - прогрессирующего угасания интеллектуальных функций, которая приводит к потере способности себя обслуживать. Только в США ею страдает около 2 миллионов людей. Причем, в развитых странах частота его увеличивается, поскольку она напрямую связана с увеличением продолжительности жизни. В большинстве случаев болезнь Альцгеймера не имеет генетической зависимости. Обычно она развивается в возрасте старше 65 лет, хотя может встречаться и раньше, и длится от 2 до 20 лет. Первым симптомом является потеря памяти. Заболевание неумолимо прогрессирует и заканчивается полнейшей беспомощностью.
Основным патоморфологическим признаком является дегенеративный процесс, характеризующийся потерей клеток в некоторых участках мозга (в частности, в корковом слое и гиппокампе). Многочисленные исследования направлены на выяснение причин болезни Альцгеймера. Внимание ученых привлек амилоидный b-протеин (АbП), основной компонент амилоидных бляшек, чрезвычайно характерных для этого заболевания. Термин "амилоидный" относится к широкой группе внеклеточных скоплений белка, обнаруженных при многих заболеваниях. Амилоидные белки, подобно крахмалу, обычно окрашиваются йодом в синий цвет, за что и получили своё название. Согласно одной гипотезе (амилоидного каскада) накопление АbП вызывает патологические изменения в мозге людей с болезнью Альцгеймера. Другие изменения, наблюдающиеся при этом заболевании, такие как нейрофибриллярные клубки и изменения сосудов, являются вторичными. АbП образуется из своего предшественника, названного "предшественником амилоидного белка" (ПАБ). Ген белка-предшественника локализован в 21 хромосоме, близко к месту, изменяющемуся при синдроме Дауна (трисомия 21). Наверно, поэтому больные синдромом Дауна, которые дожили до 50 летнего возраста, часто поражаются болезнью Альцгеймера.
ПАБ - это трансмембранный белок, состоящий из 770 аминокислотных остатков. АbП - пептид, состоящий из 39-42 аминокислот, который отщепляется в результате протеолиза от С-конца ПАБ. Он то и образует нерастворимое внеклеточное скопление. Расщепление ПАБ могут катализировать две различные протеазы. В результате действия одной из них, получившей название секретаза, образуется растворимый фрагмент, содержащий в своем составе только часть АbП (рис.18.12). Вторая является лизосомальной протеазой, в результате её действия образуется фрагмент, содержащий полную последовательность АbП. Предполагается, что именно этот фрагмент накапливается во внеклеточном пространстве и приводит к формированию гистопатологических признаков, присущих болезни Альцгеймера.
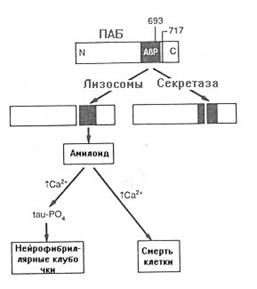
Рис.18.12. Гипотеза амилоидного каскада
ПАБ может подвергаться превращению двумя путями. Первый включает секретазу, действие которой приводит к образованию пептидов, которые не содержат полную аминокислотную последовательность амилоидного b-протеина (АbР). Эти пептиды раствориы в воде и не осаждаются с образованием амилоида. В соответствии со вторым путем действие эндосомальных-лизосомальных протеаз(ы) приводит к образованию амилоидного b-белка или пептидов, содержащих его полную аминокислотную последовательность в своем составе. Такие пептиды выпадают в осадок с образованием амилоида. Предполагается, что это приводит к формированию нейрофибриллярных клубочков и смерти клетки.
В некоторых случаях болезни Альцгеймера, особенно с ранним началом заболевания, были обнаружены мутации на С-конце ПАБ. Белковые фрагменты, которые образовываются в результате таких мутаций, содержат в своем составе АbП. Однако роль этих фрагментов до настоящего времени неясна.
Второй часть гипотезы амилоидного каскада в развитии болезни Альцгеймера основывается на том, что АbП и фрагменты, содержащие этот белок, прямо или косвенно являются нейротоксичными веществами. Замечено, что в нейронах в присутствии АbП может увеличиваться внутриклеточная концентрация Са2+. Уровень же Са2+ способен оказывать регуляторное влияние на активность некоторых протеинкиназ, которые катализируют фосфорилирование tau-белка. Таким образом, повышение уровня Са2+ может привести к гиперфосфорилированию tau и образованию спаренных спирализованных нитей, характерных для нейрофибриллярных клубочков. На рис.18.13 показана предполагаемая последовательность событий в некоторых случаях развития болезни Альцгеймера.

Рис.18.13. Гипотетическая схема последовательности событий, вовлекаемых в развитие некоторых случаев болезни Альцгеймера
Мутации гена ПАБ обнаружены только в небольшом количестве случаев этого заболевания, поэтому равновероятно существование и других патогенетических механизмов.
Гипотеза зачастую хороша не тем, что она правильная, а тем, что она стимулирует дальнейшие исследования. В частности, ключевым моментом, требующим в дальнейшем выяснения, является ответ на вопрос, первично ли накопление АbП в развитии болезни Альцгеймера или это вторичное событие, которое развивается вследствие неизвестных ещё более ранних явлений? Существуют и другие гипотезы происхождения этого заболевания, которые представляются менее вероятными на сегодняшний день. Так, было замечено, что в составе бляшек при болезни Альцгеймера часто содержится повышенное количество алюминия. Это позволило предположить, что одной из причин заболевания является увеличенное поступление его в организм с пищей. Одновременно возник вопрос, в действительности ли увеличенное отложение алюминия в бляшках вызывает болезнь Альцгеймера или уже поврежденные каким-то другим процессом клетки приобретают способность усиленно поглощать алюминий? Ответа на этот вопрос на сегодняшний день нет. С другой стороны, в ткани мозга людей, умерших от болезни Альцгеймера, часто обнаруживается существенное снижение ацетилхолина и других нейромедиаторов, однако эти изменения представляются вторичными, возникшими вследствие повреждения клеток при этом заболевании.
С раскрытием механизмов развития болезни Альцгеймера связывают разработку эффективных тестов его диагностики и лечения. К примеру, большое значение могли бы иметь соединения, которые бы ингибировали образование АbП или делали бы его растворимым в воде. В настоящее время точный дигноз болезни Альцгеймера чаще ставится на аутопсии при обнаружении характерных бляшек. Перспективной представляется разработка теста, основанного на определении количества ПАБ в цереброспинальной жидкости (ЦСЖ) с помощью специфических моноклональных антител. Считают, что в ЦСЖ людей, страдающих этим заболеванием, его уровень существенно (~ в 3 раза) ниже, чем у здоровых людей. В настоящее время нет специфической лекарственной терапии болезни Альцгеймера, хотя все более и более реальной становится возможность с помощью препаратов влиять на накопление АbП в тканях. Такой перспективой, в частности, обладает выделенный из мозга фактор роста нервов. В некоторых областях мозга больных его количество снижено. Сейчас изучается терапевтический эффект от его использования у экспериментальных животных, у которых хирургическим путем была вызвана нейрональная дегенерация.
