Классификация аминокислот
БИОЛОГИЧЕСКАЯ ХИМИЯ
Методический материал для самоподготовки)
Петрозаводск
ТЕМА 1. СТРОЕНИЕ, КЛАССИФИКАЦИЯ
И БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОКИСЛОТ
Задание:
1. Выучить предложенный теоретический материал.
2. Ознакомиться с вариантами контрольной работы по теме.
(Выполнение контрольной работы по этой теме проводится на первом лабораторном занятии в 6-м семестре, во время летней сессии).
Аминокислотный состав белков
Историческая справка. Первая аминокислота – глицин была выделена в 1820 г. методом кислотного гидролиза желатины,полностью расшифрован аминокислотный состав белков в 1938 г., когда была идентифицирована последняя аминокислота – треонин (Имеются данные, что первым был выделен аспарагин из аспарагуса в 1806 г.).
Функции аминокислот. В настоящее время известно более 300 аминокислот, они могут выполнять разные функции:
· входят в состав всех белков – их 20, и такие аминокислоты называют стандартными, или протеиногенными;
· входят в состав только редких, или определённых, белков (например, оксипролин, 5-оксилизин входят в состав коллагена; десмозин – в состав эластина);
· входят в состав других соединений (например, b-аланин входит в состав витамина В3, который необходим для синтеза КоА-SH);
· являются промежуточными метаболитами обменных процессов (например, орнитин, цитруллин);
· необходимы для синтеза биологически активных соединений, например, биогенных аминов, нейромедиаторов;
· необходимы для синтеза азотсодержащих соединений (полиаминов, нуклеотидов и нуклеиновых кислот);
· углеродный скелет аминокислот может использоваться для синтеза других соединений:
а) глюкозы – такие аминокислоты называются глюкогенными (большинство из протеиногенных);
б) липидов – кетогенными (вал, лей, иле, фен, тир);
· аминокислоты могут быть источником определенных функциональных групп – сульфатной (цистеин), одноуглеродных фрагментов (метионин, глицин и серин), аминогруппы (глутамин, аспарат).
Номенклатура аминокислот. Аминокислоты – производные карбо-новых кислот, в молекуле которых атом водорода у С, стоящего в a-положении, замещён аминогруппой. Общая формула L-изомеров аминокислот:
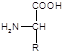
Отличаются аминокислоты между собой функциональными группами в боковой цепи (R). Каждая аминокислота имеет тривиальное, рациональное и сокращенное трех- или однобуквенное обозначение, например, глицин, аминоуксусная, гли.
Тривиальное название чаще всего связано с источником выделения или свойствами аминокислоты:
· серин входит в состав фиброина шелка (от лат. serius – шелковистый),
· тирозин впервые выделен из сыра (от греч. tyros – сыр),
· глутамин выделен из клейковины злаковых (от лат. gluten – клей),
· цистин – из камней мочевого пузыря (от греч. kystis – пузырь),
· аспарагиновая кислота – ростков спаржи (от лат. asparagus – спаржа),
· глицин от греч. glykos – сладкий.
Рациональное название складывается исходя из того, что каждая аминокислота является производной соответствующей карбоновой кислоты.
Сокращенное обозначение используют для написания аминокислотного состава и последовательности аминокислот в цепи. В биохимии чаще всего применяют тривиальное и сокращенное обозначение.
Классификация аминокислот.
Существует несколько классификаций:
1) по химической природе боковой цепи (R),
2) рациональная классификация (по степени полярности радикала, по Ленинджеру),
3) по способности синтезироваться в организме.
По химической природе боковой цепи (R) все аминокислоты делятся на:
Ациклические (алифатические):
· моноаминомонокарбоновые
(содержат 1 -NH2 и 1 -СООН группы);
· моноаминодикарбоновые
(содержат 1 -NH2 и 2 -СООН группы);
· диаминомонокарбоновые
(содержат 2 -NH2 и 1 -СООН группы);
· диаминодикарбоновые
(содержат 2 -NH2 и 2 -СООН группы).
Циклические:
1) гомоциклические (фен, тир);
2) гетероциклические:
· аминокислоты (гис, три);
· иминокислоты (про).
По Ленинджеру (по способности радикала взаимодействовать с водой) все аминокислоты делят на 4 группы:
· неполярные, незаряженные (гидрофобные) – их 8: ала, вал, лей, иле, мет, фен, три, про;
· полярные, незаряженные (гидрофильные) – их 7: сер, тре, глн, асн, цис, тир, гли;
· отрицательно-заряженные – их 2: асп, глу;
· положительно-заряженные – их 3: гис, арг, лиз.
По способности синтезироваться в организмеаминокислоты могут быть:
· заменимыми, которые могут синтезироваться в организме;
· незаменимыми, которые не могут синтезироваться в орга-низме и должны поступать с пищей.
Понятие «незаменимые» относительно для каждого вида – у человека и свиней их 10 (вал, лей, иле, тре, мет, фен, три, арг, гис, лиз), у животных с четырехкамерным желудком – 2 серосодержащие (цис, мет), у птиц – 1 (гли).
Физико-химические свойства аминокислот:
1. Растворимы в воде (лучше растворимы положительно- и отрицательно заряженные аминокислоты, затем гидрофиль-ные, хуже – гидрофобные).
2. Имеют высокую точку плавления (обусловлено тем, что в кристаллическом виде находятся в виде биполярных ионов).
3. Обладают оптической активностью, которая обусловлена наличием асимметрического атома углерода(за исключением гли). В связи с этим аминокислоты:
· существуют в виде L- и D-стереоизомеров, но в состав белков высших животных входят в основном аминокислоты L-ряда; количество стереоизомеров зависит от количестваасимметрических атомов углерода и рассчитывается по формуле 2n, где n – количество асимметрических атомов С;
· способны вращать плоскость поляризованного света вправо или влево; величина удельного вращения у разных аминокислот варьирует от 10 до 30º.
4. Амфотерные свойства (аминокислоты, кроме гли, при физиологических значениях рН и в кристаллическом виде находятся в виде биполярных ионов). Величина рН, при которой суммарный заряд аминокислоты равен 0, называется изоэлектрической точкой. Для моноаминомонокарбоновых аминокислот она лежит в интервале 5,5-6,3, диаминомоно-карбоновых – больше 7, для дикарбоновых – меньше 7.
5. Химические свойства:
· кислотные свойства, обусловленные наличием карбоксильной группы;
· основные свойства, обусловленные наличием аминогруппы;
· свойства, обусловленные взаимодействием амино-
и карбоксильной групп между собой;
· свойства, обусловленные наличием функциональных групп в боковой цепи.
