Трансаминирование аминокислот
Начальным процессом деградации аминогрупп является процесс трансаминирования. Трансаминирование - ферментативный процесс переноса NН2 - группы с аминокислоты на α - кетокислоту Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. Причём митохондриальные и цитоплазматические формы ферментов различаются по физико-химическим свойствам. Вступать в реакции трансаминирования могут почти все аминокислоты,за исключением лизина, треонина и пролина.
В качестве альфа-кетокислот, чаще используется пировиноградная, щавелевоуксусная и альфа - кетоглютаровая кислота.
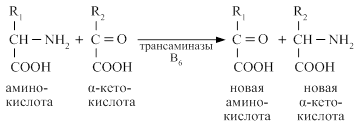
Наиболее активными тканевыми аминотрансферазами являются аланинаминотрансфераза (АлАТ) или глютамикопировиноградная трансаминаза (ГПТ) и аспарагинаминтрансаминаза (АсАТ) или глютамикощавелевоуксусная трансаминаза (ГЩТ).
Биологическое значение реакций трансаминирования заключается в следующем:
Ø происходит потеря аминогрупп из аминокислоты без выделения токсичного NH3;
Ø возможность последующего включения безазотистого остатка аминокислот в цикл Кребса с выделением энергии;
Ø способ синтеза новых заменимых аминокислот в тканях (ПВК –> ала, ЩУК –> асп, альфа - кетоглютаровая кислота –> глю);
Ø определение активности трансаминаз имеет важное диагностическое значение, так как в разных тканях преобладает активность определённых трансаминаз. В сердечной мышце высока активность аспартатаминотрансферазы, в печени – аланинаминотрансферазы.
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию, служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты
Непрямое дезаминирование
В тканях для большинства аминокислот реакции трансаминирования и окислительного дезаминирования тесно друг с другом связаны, Сочетание их получило название непрямого дезаминирования. Так как возможности окислительного дезаминирования большинства аминокислот очень малы, вначале они вступает в реакцию трансаминирования с α - кетоглютаровой кислотой. Образовавшаяся при этом глютаминовая кислота в дальнейшем активно подвергается окислительному дезаминированию под действием глютаматдегидрогеназы – высоко активного митохондриального фермента.
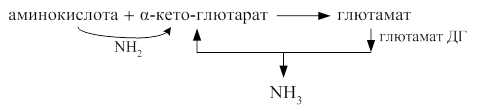
Около трети аминокислот включается в непрямое дезаминирование.
Если в отдельных органах возникает некроз (инфаркт миокарда или легких, панкреатит, гепатит и др.), то вследствие разрушения клеток тканевые трансаминазы поступают в кровь и повышение их активности в крови при данной патологии является одним из диагностических тестов. В изменении скорости трансаминирования существенная роль принадлежит нарушению соотношения между субстратами реакции, а также гормонам, особенно гликокортикоидам и гормону щитовидной железы, оказывающим стимулирующее влияние на этот процесс.
При врожденном дефекте трансаминазы, гидроксилазы, гидролазы развиваются различные виды тирозинозов(нарушение обмена тирозина)
3.Биосинтез белков (трансляция)
Основной структурой синтезируемых белков является первичная структура (последовательность аминокислот в полипептидной цепи), которая заложена в генетическом коде ДНК.
Трансляция
Для трансляции необходимы следующие факторы:
1. все виды РНК (тРНК, иРНК, рРНК);
2. аминокислоты в активной форме;
3. макроэрги;
4. ферменты;
5. добавочные белковые факторы;
6. ионы Mg2+.
Информационная РНК (иРНК) 3% РНК клетки. В первичной структуре иРНК представлены кодоны, среди которых различают инициирующие (в них первый нуклеотид А), терминирующие (в них первый нуклеотид У) и кодоны, определяющие порядок аминокислот в синтезируемом белке. На одном конце иРНК имеется «шапочка - кеп», необходимая для связывания иРНК с малой субъединицей рибосомы в начале синтеза белка. На другом конце полинуклеотидной цепи располагается полиадениловый «хвост», выполняющий защитную функцию.
Постулат молек.биологии-днк служитматрицей для синтеза иРНК, иРНК служит матрицей для синтеза белка. Это означает, что положение каждой аминокислоты в полипептидной цепи зависит от особого участка гена.
Колинеарность гена и продукта
Последовательность нуклеотидов строго соответствует последовательности аминокислот в синтезируемом белке – принцип коллинеарности.
У прокариотов обнаружено линейное соответствие последовательности кодонов гена и последовательности аминокислот в белковом продукте, или, как говорят, существует колинеарность гена и продукта.
У эукариотов последовательности оснований в гене, колинеарные аминокислотной последовательности в белке, прерываются интронами. Поэтому в эукариотических клетках аминокислотная последовательность белка колинеарна последовательности экзонов в гене или зрелой мРНК после посттранскригщионного удаления интронов.
Генкод-способ перевода четырехзначнойнуклеотиднойзаписиинформации вдвадцатизначную аминокислотную последовательностьРеализация генетического кода в клеткепроисходит в два этапа: 1) синтезмолекулыиРНК) на соответствующем участке ДНК;2)синтез белка, при к-ром последовательность нуклеотидовИрнк переводится в соответствующую последовательность аминокислот
Генетический код имеет ряд характеристик.
· Триплетность –1 аминокислота кодируется тремя нуклеотидами. Из 4 видов нуклеотидов ДНК при триплетности кода возможно 64 различных сочетания, что достаточно для кодирования 20 аминокислот.
· Однозначность – 1 триплет кодирует только 1 аминокислоту.
· Вырожденность – для кодирования 1 аминокислоты может быть несколько триплетов
· Непрерывность – между триплетами отсутствуют нуклеотиды, не принадлежащие соседним триплетам.
· Неперекрываемость – один нуклеотид не может одновременно принадлежать 2-м триплетам.
· Универсальность – код в разных организмах одинаков, отвечает за одни и те же аминокислоты.
Таким образом, код ДНК является линейным непрерывным и однонаправленным.
Билет27
Липиды
(жиры и жироподобные вещества) – неоднородные в химическом отношении органические вещества, нерастворимые в воде, но растворимые в органических растворителях.Они состоят из различных спиртов и жирных кислот.
Классификация липидов
Наиболее принятой является классификация липидов по виду спирта, входящего в их состав. Согласно ей выделяют:
2. Глицеринсодержащие липиды:
а) триацилглицерины (жиры);
б) глицерофосфолипиды;
3. Сфингозинсодержашие липиды:
а) сфингофосфолипиды;
б) сфингогликолипиды (цереброзиды, ганглиозиды);
4. Холестеринсодержащие липиды:
а) свободный холестерин;
б) эфиры холестерина, стероиды.
