Механизм действия ферментов
В 1903 г. В. Генри сделал вывод о том, что необходимой стадией ферментативного катализа является соединение фермента с субстратом, в результате чего образуется фермент-субстратный комплекс. Развитие этой идеи привело к созданию общей теории действия ферментов; особенно большой вклад в неё в 1913г. внесли Л. Михаэлис и М. Ментен. Согласно их гипотезе процесс ферментативного катализа можно разделить на три стадии:
1) диффузия субстрата к ферменту и стерическое связывание его с активным центром фермента, т.е. образование фермент-субстратного комплекса (ES);
2) преобразование первичного комплекса в один или несколько активированных фермент-субстратных комплексов (ES*, ES**…);
3) отделение продуктов (Р) реакции от активного центра и диффузия его в окружающую среду.
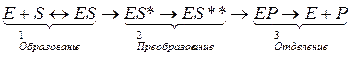
Первая стадия обычно непродолжительна и зависит от концентрации субстрата в среде, а также его диффузии к активному центру фермента. Комплекс образуется практически мгновенно. Субстрат присоединяется к активному центру в нескольких точках, образуя хелатные (клешневидные) комплексы. Присоединение осуществляется связями разного характера, в основном слабыми (водородные, электростатические, гидрофобные, координационные), ковалентные связи встречаются редко. На этой стадии изменение энергии активации незначительно, ориентация субстрата и активного центра способствует их сближению и прохождению реакции.
Вторая стадия наиболее медленная и лимитирует скорость всего катализа в целом. Её длительность зависит от энергии активации данной химической реакции. На этой стадии происходит расшатывание связей субстрата, их разрыв или образование новых связей в результате взаимодействия с активными группами фермента. Благодаря образованию активированных переходных комплексов снижается энергия активации реакции.
Третья стадия практически мгновенна. Она определяется скоростью диффузии продуктов реакции в окружающую среду.
Ферменты – истинные катализаторы. Они значительно повышают скорость строго определённых химических реакций, которые в отсутствии ферментов протекают очень медленно. Ферменты не могут влиять на положение равновесия ускоряемых реакций; при этом в ходе реакций они не расходуются и не претерпевают необратимых изменений.
Ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное (переходное) состояние при данной температуре. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 14.10).
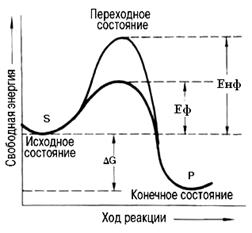
Рис. 14.10. Энергетический механизм ферментативной и неферментативной химических реакций: S – исходный субстрат; Р – продукт; DЕнф – энергия активации неферментативной реакции; DЕф – энергия активации ферментативной реакции; DG – стандартное изменение свободной энергии
Существует два основных пути повышения скорости химической реакции. Первый путь – повышение температуры, т.е. ускорение теплового движения молекул, которое приводит к увеличению доли молекул, обладающих достаточной энергией для достижения переходного состояния. В этой точке существует равная вероятность того, что достигшие её молекулы вступят в реакцию с образованием продукта или вернутся на уровень непрореагировавших молекул. Скорость любой химической реакции пропорциональна концентрации молекул, находящихся в переходном состоянии.
Второй путь – добавление катализатора. Они ускоряют химические реакции, находя «обходные пути», позволяющие молекулам преодолевать активационный барьер на более низком энергетическом уровне. На промежуточной стадии реакции катализатор (С) взаимодействует с реагентом (А) с образованием нового комплекса СА, переходному состоянию которого соответствует значительно сниженная энергия активации по сравнению с переходным состоянием реагента А в некатализируемой реакции. Затем комплекс СА распадается на продукт (Р) и свободный катализатор, который может опять соединиться с другой молекулой А и повторить весь цикл:
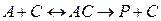
Существуют четыре основных фактора, определяющих способность ферментов ускорять химические реакции.
1.Сближение и ориентация. Фермент способен связывать молекулу субстрата таким образом, что атакуемая им связь оказывается не только расположенной в непосредственной близости от каталитической группы, но и правильно ориентированной по отношению к ней. В результате вероятность того, что комплекс ES достигнет переходного состояния, сильно увеличивается (рис. 14.11).
| а | б | в |
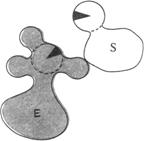 | 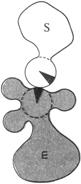 | 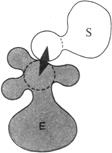 |
| Рис. 14.11. Процессы сближения и ориентации при взаимодействии молекулы субстрата S с каталитической группой в активном центре фермента Е: а – неправильная ориентация, неправильное сближение; б – правильное сближение, неправильная ориентация; в – правильное сближение, правильная ориентация |
2. Напряжение и деформация: индуцированное соответствие. Присоединение субстрата может вызывать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, а также несколько деформируют связанный субстрат, упрощая тем самым достижение комплексом ES переходного состояния.
При этом возникает так называемое индуцированное соответствиефермента субстрату. Таким образом, небольшие изменения третичной или четвертичной структуры относительно крупной молекулы фермента могут играть роль механического рычага для молекулы субстрата. Возможно, именно по этой причине ферменты представляют собой белки и, следовательно, по своим размерам значительно превосходят молекулы большинства субстратов.
3. Общий кuслотно-основный катализ. В активном центре фермента могут находиться группы специфических аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов (рис. 14.12). Такие кислотные или основные группы общего типа представляют собой мощные катализаторы многих органических реакций, протекающих в водных системах.
а - СООН - +NH3 - SH 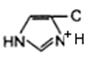 | б - СОО- - NH2 - S- 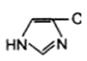 |
Рис. 14.12. Функциональные группы аминокислотных остатков, принимающие участие в каталитических процессах: а – протон-донорные группы; б – протон-акцепторные группы
4. Ковалентный катализ. Некоторые ферменты реагируют со своими субстратами, образуя очень нестабильные, ковалентно связанные фермент-субстратные комплексы, из которых в ходе последующей реакции образуются продукты реакции, причем значительно быстрее, чем в случае некатализируемых реакций:
| Некатализируемая реакция | RX + H2O → ROH + HX |
| Катализируемая реакция | RX + E-OH → ROH + EX EX + H2O → E-OH + HX |
| Суммарная реакция | RX + H2O → ROH +HX |
В некоторых ферментативных реакциях фермент замещает функциональную группу R в субстрате RX, в результате чего образуется ковалентный комплекс ЕХ. Он нестабилен и гидролизуется значительно быстрее, чем RX. К ферментам, осуществляющим ковалентный катализ, отноcится химотрипсин.
Перечисленные выше факторы, по-видимому, в различной степени ускоряют химические реакции. Однако для многих ферментов пока не известно точного механизма, обеспечивающего ускорение той или иной специфической реакции.
