Функции и строение углеводов
Химическое строение и биологическая роль углеводов. Аэробный распад глюкозы, энергетика. Анаэробный гликолиз. Центральная окислительно-восстановительная реакция гликолиза. Энергетика. Синтез и распад гликогена. Регуляторные ферменты. Понятие о глюконеогенезе и пентозофосфатном пути
Функции и строение углеводов
Все углеводы условно делят на две группы.
1.1. Углеводы с преимущественно энергетической функцией
При окислении 1 г углеводов выделяется примерно 16,9 кДж энергии.
1. Моносахариды (глюкоза, фруктоза, галактоза). При полном окислении одной молекулы глюкозы образуется 30-32 молекулы АТФ.
2. Олигосахариды (в пище чаще используются дисахариды сахароза – свекловичный сахар, при гидролизе образуются глюкоза и фруктоза и лактоза – молочный сахар, при гидролизе образуются глюкоза и галактоза).
3. Гомополисахариды. Крахмал в растениях, гликоген в животных клетках), состоят из остатков α-D-глюкозы, соединенных α(1→4) и в местах ветвления α(1→6)-гликозидными связями (рис. 12.1).
В растениях глюкоза запасается в виде крахмала, который может быть в двух формах: 1) амилоза – неразветвленный тип крахмала, в котором остатки глюкозы связаны α-1,4-гликозидными связями; 2) амилопектин – разветвленная форма крахмала, в которой на тридцать α-1,4-гликозидных связей приходится одна α-1,6-гликозидная связь. В молекулах гликогена количество ветвлений, т.е. наличие α-1,6-гликозидных связей, встречается примерно в три раза чаще. Молекулы гликогена и крахмала за счет большого количества концевых остатков глюкозы служат для быстрого резервирования или освобождения большого числа свободных молекул глюкозы. Более половины углеводов в организме человека имеют происхождение из крахмала пищи.
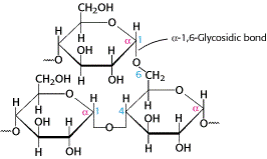
Рис. 1. Типы гликозидных связей в крахмале и гликогене: α-1,4-гликозидные связи в цепях остатков глюкозы и α-1,6-гликозидные связи в точках ветвления.
У человека в печени и мышцах содержится до 450 г гликогена. В гепатоцитах гликоген запасается в виде розеток (α-агрегаты), состоящих из β-частиц. Малые β-частицы находятся в цитоплазме мышечных клеток и содержат до 60000 остатков глюкозы. Гомополисахариды – это способ сохранения миллионов молекул глюкозы без увеличения осмотического давления.
2. Углеводы с преимущественно структурной функцией
1. Гомополисахариды. Целлюлоза наиболее распространенный структурный полисахарид растительного мира; на ее долю приходится более половины всего органического углерода биосферы. Примерно 1015 кг целлюлозы обменивается на Земле за год. Целлюлоза представляет собой линейный неразветвленный полисахарид, состоящий из β-D-глюкопиранозных звеньев, соединенных β(1→4) гликозидными связями. Эти линейные молекулы располагаются параллельно друг другу, между ними возникают водородные связи, образуются прочные микрофибриллы (рис. 2).
Микрофибриллы целлюлозы вместе с сопровождающими веществами (гемицеллюлозы, лигнин, пектины) образуют клеточную стенку растений. Млекопитающие утратили фермент целлюлазу и не могут переваривать волокна целлюлозы в отличие от крахмала. Целлюлоза является незаменимым компонентом пищи (30 г/сутки), поскольку она необходима для перистальтики кишечника.
2. Гетерополисахариды.
В состав олиго- и гетерополисахаридов входят модифицированные формы углеводов (рис. 3).
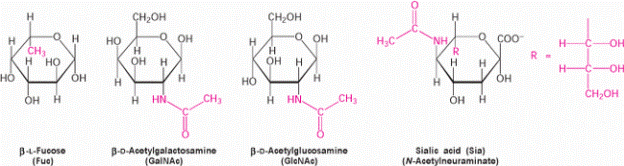
Рис. 2. Модифицированные моносахариды. Включают дополнительные группы, отличные от гидроксильной группы. Эти моносахариды выделяются на поверхность клетки.
Подписи слева направо: β-L-фукоза (Fuc), β-D-ацетилгалактозамин (GalNAc), β-D-ацетилглюкозамин (GlсNAc), Сиаловая кислота, N-ацетилнейраминовая кислота (Sia)
Наиболее часто используемые сокращения при названии углеводов: Fuc – фукоза, Gal – галактоза, GalNAc – N-ацетилгалактозамин, GlcNAc - N-ацетилглюкозамин, Man – манноза, Sia – сиаловая кислота, NeuNAc – N-ацетилнейраминовая кислота (сиаловая кислота)
Гликозамингликаны (ГАГ, старое название - мукополисахариды) содержат чередующиеся парные звенья, состоящие из остатков аминосахаров и гексуроновых кислот, реже моносахаридов; обладают большой молекулярной массой и всегда связаны с белками (за исключением гиалуроновой кислоты); образуют основное вещество внеклеточного матрикса соединительной ткани. Все ГАГ, кроме гиалуроновой кислоты, сульфатированы.
Гиалуроновая кислота построена из повторяющегося дисахарида β-D-глюкуроновая кислота и β-N-ацетил-D-глюкозамин, соединенных β(1→3) гликозидной связью. Дисахаридные единицы соединены β(1→4) гликозидной связью. Это самый высокополимерный ГАГ (м.м. 105-107 Да). Как полианион, гиалуроновая кислота обладает способностью связывать большое количество воды, а также ионы кальция, натрия, калия. Входит в состав протеогликанов, содержится в пупочном канатике, стекловидном теле, внутрисуставной жидкости; у многих бактерий содержится в защитной капсуле, определяя вирулентность бактерии. Хондроитинсульфаты являются основным компонентом хрящей, сухожилий, роговицы глаза; содержатся также в коже и костях. Хондроитинсульфаты А и С состоят из повторяющихся звеньев дисахарида β-D-глюкуронозил-(1→3)-β-N-ацетил-D-галактозамина, соединенных β(1→4) гликозидной связью. Хондроитинсульфат А содержит сульфогруппу в С-4 положении N-ацетил-D-галактозамина, а хондроитинсульфат С сульфатирован при С-6. В эту группу входят также дерматансульфат, кератансульфаты, гепарин и гепарансульфат
Гликозамингликаны обычно входят в состав гликопротеинов. Они присоединяются О-гликозидной связью к ОН-группам боковых радикалов серина или треонина корового (от лат. «cor» - сердце) белка, реже – к аминогруппе аспарагина.
В протеогликанах до 95% от массы приходится на углеводные компоненты и 5% - на белки. Протеогликаны различных тканей имеют свои специфические особенности строения, разный состав ГАГ, но принцип химического строения одинаков: коровый, или сердцевидный, белок занимает срединное положение, и к нему по всей его длине присоединяются молекулы ГАГ. Коровые белки протеогликанов представлены одной полипептидной цепью разной молекулярной массы. ГАГ присоединяются к коровому белку ковалентными связями. Протеогликаны являются структурными компонентами соединительной ткани, опосредуют адгезию клеток к экстрацеллюлярному матриксу и стимулируют пролиферацию клеток.
Присоединяясь к линейной структуре гиалуроновой кислоты, протеогликаны образуют очень крупные надмолекулярные структуры – протеогликановые агрегаты (ПГА), составляющие основу (матрикс) соединительной ткани, в который погружены клетки и волокна. Присоединение протеогликанов к гиалуроновой кислоте осуществляется при помощи особых связывающих белков, обладающих гидрофобными свойствами. Гиалуроновая кислота может объединить в ПГА до 200 молекул протеогликанов. Полимерные цепи ГАГ в составе ПГА за счет наличия одноименных зарядов и связывания молекул воды полярными группами ГАГ образуют структуру наподобие щетки для мытья бутылок.
Больше всего протеогликанов содержится в анатомических структурах, подвергающихся механической нагрузке и деформации: межпозвоночные диски, хрящи, сухожилия, связки, мениски, кожа.
Агар-агар – смесь агарозы и агаропектина. Агароза состоит из чередующихся остатков D-галактозы и 3,6-ангидро-L-галактозы, соединенных поочередно β(1→4)- и α(1→3) гликозидными связями. Агаропектин содержит цепочки, образуемые остатками D-галактопиранозы, часть которых сульфатирована. Агар-агар растворяется в воде при нагревании, при остывании образуются гели (в микробиологии используется для создания питательных сред, а в кондитерской промышленности для приготовления желе, пастилы, мармелада). Агар-агар добывают из морской багряной водоросли анфельции.
- Гликопротеины и гликолипиды принимают участие в построении клеточных мембран и выполнении некоторых клеточных функций, таких как рост, адгезия и др. В состав клеточных стенок бактерий входит пептидогликан – муреин. Он образует каркас стенок бактерий. Муреин стенки Staphylococcus aureus включает муропептид – дисахарид, в котором N-ацетил-D-глюкозамин соединен β(1→4) гликозидной связью с N-ацетилмурамовой кислотой.
Обмен углеводов
Глюкоза-это центральный метаболит обмена углеводов.
Основнымиисточникамиглюкозы являются: 1) пища; 2) распад гликогена; 3) синтез глюкозы из не углеводных предшественников (глюконеогенез).
Основные пути расходования глюкозы: 1) распад глюкозы с целью получения энергии (аэробный и анаэробный гликолиз); 2) синтез гликогена; 3) пентозофосфатный путь распада для получения других моносахаридов и восстановленного НАДФН; 4) синтез других соединений (жирные кислоты, аминокислоты, гетерополисахариды и др.).
В кровь поставляют глюкозу: 1) кишечник из пищи; 2) печень и почки посредством дефосфорилирования глюкозо-6-фосфата, так как только в этих органах имеется в достаточном количестве фермент глюкозо-6-фосфатаза. Остальные ткани потребляют глюкозу.
Переваривание углеводов
Главными углеводами пищи являются полисахариды (крахмал, гликоген, целлюлоза), дисахариды (лактоза, сахароза) и, в меньшей степени, моносахариды (глюкоза, фруктоза).
Крахмал, широко распространенный резервный полисахарид растений, относится к наиболее важным углеводным компонентам пищевого рациона. В растениях крахмал содержится в хлоропластах листьев, плодах, семенах и клубнях. Особенно высоко содержание крахмала в зерновых культурах (до 75% от сухой массы), клубнях картофеля (примерно 65%) и других запасающих частях растений.
Гликоген, важнейший резервный полисахарид животного мира, содержится в печени и мышцах. Целлюлоза является самым распространенным органическим соединением. В клеточных стенках растений на долю целлюлозы приходится 40-50%, а в таком важнейшим сырье, как хлопковое волокно, - до 98%.
Лактоза (молочный сахар) является важнейшим углеводным компонентом молока млекопитающих. В коровьем молоке содержится до 4,5% лактозы, в женском молоке – до 7,5%. В растениях сахароза служит растворимым резервным дисахаридом, а также той транспортной формой, которая легко переносится по растению. Человека сахароза привлекает своим сладким вкусом. Источником сахарозы служат растения с высоким содержанием сахарозы, такие, как сахарная свекла и сахарный тростник. Мед образуется при ферментативном гидролизе цветочного нектара в пищеварительном тракте пчелы и содержит примерно равные количества глюкозы и фруктозы. Фруктоза в свободной форме содержится во фруктовых соках (фруктовый сахар) и меде.
Углеводы пищи, содержащие a-(1,4)- и a-(1,6)-гликозидные связи, перевариваются ферментами пищеварительного тракта (крахмал, гликоген). Углеводы с b-(1,4)-гликозидными связями (клетчатка, целлюлоза) ферментами человека не перевариваются. Основным типом ферментов, переваривающих углеводы в ЖКТ, являются a-гликозидазы (расщепление a-гликозидных связей). Эти ферменты специфичны по отношению к связи, структуре и конфигурации моносахаридных единиц.
1. Расщепление крахмала и гликогена у человека начинается в ротовой полости, где содержатся ферменты α-амилаза и мальтаза. α-Амилаза (S-амилаза) расщепляет в полисахаридах внутренние α-1,4-связи, т.е. является эндоамилазой. Фермент активен в нейтральной или слабощелочной среде и активируется ионами хлора.
У высших растений имеется фермент β-амилаза, который отщепляет от крахмала дисахарид мальтозу и выполняет важную роль в мобилизации крахмала.
γ-Амилаза клеток животных и человека отщепляет один за другим глюкозные остатки от конца полигликозидной цепочки. Различают кислые и нейтральные γ-амилазы в зависимости от того, в какой области рН они проявляют максимальную активность. В органах и тканях человека и млекопитающих кислая γ-амилаза локализована в лизосомах, а нейтральная – в эндоплазматическом ретикулуме и цитозоле.
В результате действия α-амилазы образуются декстрины (содержат около 8 остатков глюкозы с одной или более α-1,6-гликозидными связями), мальтотриоза и мальтоза. Мальтаза расщепляет мальтозу на 2 молекулы глюкозы и действует при длительном жевании пищи.
2. В желудке нет ферментов, расщепляющих углеводы. Действие α-амилазы слюны прекращается, так как желудочное содержимое имеет кислую реакцию. Переваривание углеводов происходит некоторое время в глубоких слоях пищевого комка под действием α-амилазы слюны.
3. В двенадцатиперстной кишке переваривание углеводов происходит под действием ферментов панкреатического сока: панкреатической α-амилазы (Р-амилаза), расщепляющей α-1,4-гликозидные связи в молекулах декстринов, и амило-1,6- и олиго-1,6-гликозидаз, расщепляющих α-1,6-гликозидные связи.
При недостаточности этого фермента в кале находят зерна непереваренного крахмала.
4. В кишечном соке содержатся дисахаридазы, которые расщепляют дисахариды: мальтаза – мальтозу на 2 молекулы глюкозы, сахараза – сахарозу на глюкозу и фруктозу, лактаза – лактозу на глюкозу и галактозу, трегалаза – трегалозу (α-1,1-гликозидные связи, дисахарид, находящийся в грибах) – на 2 молекулы глюкозы, изомальтаза – изомальтозу (α-1,6-гликозидные связи) на 2 молекулы глюкозы. Эти ферменты действуют на щеточной кайме кишечного эпителия - пристеночное пищеварение.
Растительная пища богата пищевыми волокнами (целлюлоза, гемицеллюлоза, пектины, легнины), которые не перевариваются ферментами желудочно-кишечного тракта. Некоторые из них (целлюлоза) перевариваются ферментами бактерий толстого кишечника: целлюлаза расщепляет целлюлозу до целлобиозы; целлобиаза расщепляет целлобиозу на две молекулы β-D-глюкозы. β-D-Глюкоза затем превращается в органические кислоты: молочную, пировиноградную и др.
Пищевые волокна выполняют ряд важных функций в организме: 1) необходимы для нормальной перистальтики кишечника; 2) адсорбируют вещества, продуцируемые кишечными бактериями (например, токсины); 3) предупреждают развитие опухолевых процессов в кишечнике; 4) снижают всасывание холестерола из кишечника и способствуют выведению желчных кислот из организма.
Таким образом, в процессе переваривания углеводы пищи распадаются на моносахариды (преимущественно глюкоза, фруктоза и галактоза), которые всасываются кишечной стенкой и поступают в кровь.
Всасывание моносахаридов.Глюкоза составляет около 80% образовавшихся моносахаридов. Скорость всасывания отдельных моносахаридов различна и в сравнении с глюкозой составляет: глюкоза – 100%, галактоза – 110%, фруктоза – 43%, манноза – 20%, ксилоза – 15%, арабиноза – 9%. Видно, что глюкоза и галактоза всасываются быстрее, чем другие моносахариды. Всасывание маннозы, ксилозы и арабинозы осуществляется преимущественно путем простой диффузии; глюкоза и галактоза всасываются путем вторичного активного транспорта, сопряженного с переносом Na+; фруктоза всасывается путем облегченной диффузии. Только в клетки печени и мозга транспорт глюкозы может осуществляться по механизмам пассивной диффузии и скорость поступления регулируется ее концентрацией в крови. Во всех других тканях транспорт глюкозы осуществляется по механизмам облегченной диффузии, который стимулируется инсулином.
Поступление глюкозы из крови в клетки у млекопитающих осуществляется с помощью специальных переносчиков глюкозы – GLUT1, GLUT2, GLUT3, GLUT4, GLUT5 (glucose transporter). Переносчики глюкозы представляют собой семейство структурно близких мембранных белков с различными функциями. Распределение этих белков-переносчиков в тканях отражает их роль и особенности метаболизма глюкозы.
Гликолиз
Гликолиз (Greek glucose – сахар, lysis – разрушение) – последовательность реакций превращения глюкозы до пирувата. В процессе гликолиза часть свободной энергии распада глюкозы превращается в АТФ и НАДН. Гликолиз – это анаэробный процесс, игравший ведущую роль в энергетическом обеспечении клеток до аккумуляции в атмосфере определенных количеств кислорода. Исследования гликолитического превращения глюкозы были суммированы в 1940 г. Г.Эмденом, О.Мейергофом и Я.Парнасом и эти метаболические превращения получили альтернативное название «путь Эмбдена-Мейергофа-Парнаса».
Суммарная реакция гликолиза:
Глюкоза + 2 Рн + 2 АДФ + 2 НАД+→ 2 пируват + 2 АТФ + 2 НАДН + 2Н+ + 2 Н2О
В анаэробных превращениях глюкозы до 2 молекул пирувата освобождается -21 ккал/моль (-88 кДж/моль) энергии.
Основные признаки гликолиза.
1. Протекает во всех клетках организма. Ферменты локализованы в цитозоле клеток.
2.В анаэробных условиях (в отсутствии кислорода) образующийся пируват превращается в лактат. В аэробных условиях (присутствие кислорода) пируват окисляется до ацетил-КоА, который затем вступает в ЦТК, где его ацетильная группа окисляется до СО2 и Н2О.
3.В клетках, лишенных митохондрий (эритроциты, роговая оболочка глаза, хрусталик глаза) гликолиз является главным источникомобразования АТФ. В клетках, имеющих митохондрии, гликолиз являетсяэтапом аэробного окисления углеводов.
4. Наиболее активнопротекаетв мозге, поскольку окисление глюкозы является основным источником энергии для нервной ткани. У взрослого человека около половины глюкозы используется мозгом.
5. В анаэробных условиях гликолиз – единственный процесс в организме животных, растений и многих микроорганизмов, приводящий к образованию АТФ; в организме человека и животных гликолиз позволяет поддерживать интенсивную работу скелетной мышцы в условиях недостатка кислорода.
6. Промежуточные продукты гликолиза используются для биосинтеза заменимых аминокислот и глицерола.
3.3.1. Гликолиз как специфический путь катаболизма глюкозывключает 10 реакций и протекает в цитозоле одинаково в аэробных и анаэробных условиях.
1. Фосфорилирование глюкозы осуществляется ферментами: неспецифической гексокиназой с низкой константой Михаэлиса (10-5 М), и присутствующей преимущественно в печени специфической глюкокиназой (Кm = 10-3 М). Активность глюкокиназы индуцируется глюкозой пищи. Оптимальная концентрация глюкозы крови для глюкокиназы 5 ммоль/л. Реакция фосфорилирования глюкозы необратима. Оба фермента фосфорилируют глюкозу с помощью Mg-АТФ комплекса. Глюкозо-6-фосфат не проходит через клеточные мембраны и является ключевой молекулой различных внутриклеточных путей обмена углеводов – гликолиза, гликогенолиза, глюконеогенеза и пентозофосфатного пути.
2. Изомеризация Г-6-Ф во фруктозо-6-фосфат катализируется фосфогексоизомеразой. Реакция обратима. Изомеризуется только a-аномер Г-6-Ф. Это один из наиболее активных ферментов гликолиза.
3. Фосфорилирование Ф-6-Ф во Ф-1,6-БФ, фермент фосфофруктокиназа (ФФК-I). Реакция требует АТФ и Mg2+. Это самая медленная реакция специфического пути катаболизма глюкозы и поэтому лимитирует скорость всего процесса. Реакция необратима. ФФК - аллостерический регуляторный фермент.
4. Расщепление Ф-1,6-БФ на две фосфотриозы катализируется ферментом фруктозобисфосфат-альдолазой. В реакции образуются глицеральдегид-3-фосфат (ГАФ) и диоксиацетонфосфат (ДАФ).
5. Изомеризация триозофосфатизомеразой. Равновесие сдвинуто в сторону ДАФ (95%) и 5% ГАФ. Однако в последующие реакции вступает только ГАФ. Итак, 1 молекула гексозы распалась на 2 молекулы фосфотриоз, которые далее превращаются одинаково.
6. Окисление ГАФ. Обе молекулы ГАФ дегидрируются с одновременным присоединением неорганического фосфата с помощью фермента глицеральдегид-3-фосфатдегидрогеназы (ГАФ-ДГ) в 1,3-бисфосфоглицериновую кислоту. Фермент состоит из 4-х субъединиц. В активном центре фермента находится SH-группа (цис-149) и связанный кофермент НАД+. Вначале ГАФ присоединяется к ферменту по SH-группе с образованием тиополуацеталя. При его окислении (дегидрировании) образуется богатый энергией тиоэфир. Затем протоны и электроны переносятся со связанного с ферментом НАД на цитоплазматический, а присоединяющийся Рн ведет к образованию 1,3-бисфосфоглицериновой кислоты. Таким образом альдегид окисляется в кислоту, а энергия окисления аккумулируется в виде ~Р (макроэргического фосфата). Существует обязательный порядок связывания с ферментом субстратов и отделения от него продуктов реакции: 2 ГАФ + 2 Н3РО4 + 2 НАД+® 2 1,3-БФГК + 2 НАДН+Н+.
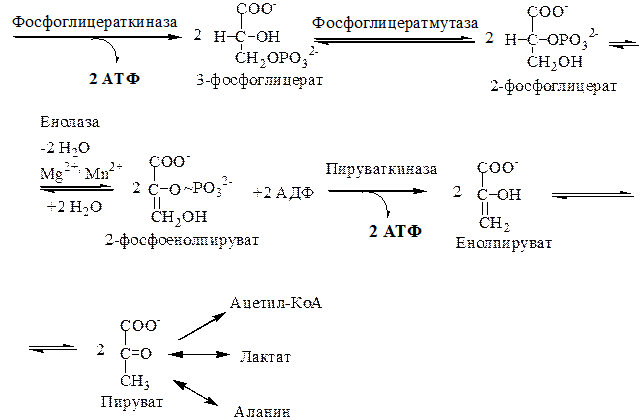
7. Фермент фосфоглицераткиназа обеспечивает субстратное фосфорилирование АДФ с образованием АТФ.
8. Перенос фосфата в положение С2 катализируется фосфоглицератмутазой. В качестве «косубстрата» участвует 2,3-бисфосфоглицерат и необходимы ионы Мg2+.
В большинстве тканей содержание 2,3-бисфосфоглицерата незначительное, но в эритроцитах количество этого вещества достигает 4 мМ. Это связано с участием 2,3-бисфосфоглицерата в транспорте кислорода гемоглобином, он снижает сродство гемоглобина к кислороду.
9. Енолизация. Фермент енолаза. Требует обязательного присутствия ионов Мg2+, Мn2+.
Енолаза блокируется флюоридом. Это используется для сохранения глюкозы в консервированной крови.
При енолизации происходит образование макроэргической связи (61,9 кДж/моль) в составе фосфоенолпирувата (ФЕП).
10. Фермент пируваткиназа обеспечивает субстратное фосфорилирование АДФ с образованием АТФ.
Итогом 10 реакций специфического пути катаболизма глюкозы в цитозоле клеток является: 2 молекулы пирувата; 2 молекулы НАДН+Н+; 4 молекулы АТФ образовалось, но израсходовано 2 молекулы АТФ (+2 молекулы АТФ).
3.3.2. Необратимые реакции гликолиза. Большинство реакций гликолиза является обратимыми. Три реакции, катализируемые ферментами гексокиназой (глюкокиназой), фосфофруктокиназой и пируваткиназой необратимы. На этих этапах осуществляется регуляция гликолиза.
Регуляция гликолиза
1. Первый фермент гликолиза – гексокиназа ингибируется продуктом реакции (глюкозо-6-фосфат).
Высокая внутриклеточная концентрация глюкозо-6-фосфата сигнализирует о том, что не требуется поступление глюкозы в клетку для получения энергии или запасания в виде гликогена. Ингибирование фосфофруктокиназы ведет к повышению концентрации фруктозо-6-фосфата, а, следовательно, и глюкозо-6-фосфата и ингибированию гексокиназы. Для контроля уровня гликемии в печени имеется специальный изофермент гексокиназы – глюкокиназа. Поскольку фермент имеет в 50 раз меньшее сродство к глюкозе, он функционирует при синтезе гликогена или жирных кислот из избытка глюкозы. Низкая аффинность глюкокиназы печени к глюкозе позволяет обеспечивать мышцы и мозг энергией при низких концентрациях глюкозы в крови.
2. Высокий уровень АТФ аллостерически ингибирует активность фосфофруктокиназы в печени (тетрамер с молекулярной массой 340 кДа), уменьшая его сродство к фруктозо-6-фосфату. Высокая концентрация АТФ превращает гиперболическую кривую связывания фруктозо-6-фосфата в сигмоидную. Этот эффект АТФ оказывает, связываясь с молекулой фермента вне зоны активного центра.
3. АМФ отменяет ингибиторный эффект АТФ и активность фосфофруктокиназы повышается, если отношение АТФ/АМФ уменьшается. Иными словами, гликолиз активируется при уменьшении энергетического заряда клетки.
4. Снижение величины рН также ингибирует активность фосфофруктокиназы. Инибирование фермента протонами предупреждает избыточное образование молочной кислоты и развитие ацидоза.
5. Фосфофруктокиназа ингибируется цитратом, первым метаболитом цикла трикарбоновых кислот.

6. В 1980 году был открыт новый регулятор активности фосфофруктокиназы - фруктозо-2,6-бисфосфат. Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу путем повышения ее сродства к фруктозо-6-фосфату и уменьшения ингибиторного эффекта АТФ.
7. Пируваткиназа контролирует поток метаболитов из гликолиза. Имеется несколько изоферментов пируваткиназы (тетрамерный белок с субъединицами молекулярной массой по 57 кДа): L-тип характерен для печени, а М-тип – для мышц и мозга. Фруктозо-1,6-бисфосфат активирует оба изофермента пируваткиназы, а АТФ и аланин – ингибируют их.
