Физико-химические свойства белков
Белки относятся к высокомолекулярным соединениям. Относительная молекулярная масса белков - от 5000 до миллионов а.е.м. Для определения молекулярной массы белков применяют седиментационный анализ, гель-электрофорез, гель-хроматографию. Молекулярную массу вычисляют по скорости седиментации; последнюю выражают через константу седиментации S (сведберг).
Характерные физико-химические свойства белков:
- оптическая активность;
- способность к поглощению УФ-лучей при 280 нм (имеет важное значение для количественного определения белков);
- высокая вязкость растворов;
- способность к набуханию;
- низкое осмотическое и высокое онкотическое давление;
- подвижность в электрическом поле;
- незначительная диффузия;
- белки не проникают через полупроницаемые мембраны (как биомембраны, так и мембраны искусственного происхождения).
Белки – полиэлектролиты, т.к. имеют фунциональные группы, способные к электролитической диссоциации.
Иизоэлектрическая точка (рI) – рН раствора, при котором суммарный заряд молекулы белка, обладающего амфотерными свойствами, равен нулю. Молекула белка неподвижна в электрическом поле. В изоэлектрической точке белки обладают наименьшей растворимостью и легко осаждаются. Для большинства белков тканей животных и человека рI = 5,5-7,0.
Изоионный раствор белка - раствор, который не содержит никаких других ионов, кроме ионизированных остатков аминокислот белковой молекулы и ионов, образующихся при диссоциации воды. Значение рН изоионного раствора белка называют его изоионной точкой. Изоионная и изоэлектрическая точка белка совпадают только в том случае, когда обе равны 7.
КЛАССИФИКАЦИЯ БЕЛКОВ
Согласно функциональному принципу различают 12 главных классов белков:
1) каталитически активные (ферменты);
2) гормоны;
3) регуляторы активности генома;
4) защитные (антитела, белки свертывающей и противосвертывающей систем крови);
5) ингибиторы ферментов;
6) транспортные;
7) мембранные;
8) сократительные;
9) рецепторные;
10) токсические;
11) белки вирусной оболочки;
12) белки с прочими функциями.
Различают a-, β-, a+β- и a/β-белки:
- a-белки содержат a-спирали (более 60%);
- β-белки имеют β-структуру (не менее двух антипараллельных цепей);
- a+β–белки включают те и другие структуры в одной полипептидной цепи;
- a/β-белки состоят из a- и β-структур, которые чередуются вдоль домена или полипептидной цепи.
По химическому составу белки делят на 2 группы.
Простые белкисостоят только из остатков аминокислот. При гидролизе образуют только свободные аминокислоты.
Сложные белки двухкомпонентны: состоят из простого белка и небелковой части (простетической группы).
ПРОСТЫЕ БЕЛКИ
Альбумины и глобулины.
Альбумины – белки, широко представленные в составе тканей животных и растений. Содержатся в сыворотке крови, белке яиц, молоке, в семенах растений. Хорошо растворимы в воде, солевых растворах, кислотах и щелочах. На альбумины приходится около 75-80% осмотического давления белков сыворотки крови. Функцией альбуминов крови является также транспорт жирных кислот.
Глобулины - группа животных и растительных белков, широко распространённых в природе. Относятся к глобулярным белкам. Растворимы в слабых растворах нейтральных солей, разбавленных кислотах и щелочах. a-Фракция глобулинов содержится в крови в комплексе с билирубином и с липопротеинами высокой плотности. Представителем фракции β-глобулинов является протромбин -предшественник тромбина, участвующего в свертывании крови. Фракция g-глобулинов наиболее гетерогенная. Важнейшие g-глобулины - иммуноглобулины.
Содержание альбуминов и глобулинов в плазме крови человека около 7%. Белковй коэффициент - отношение альбумин/глобулин - имеет диагностическое значение. В норме он близко к 2, а при ряде заболеваний может изменяться, например, уменьшается при воспалительных заболеваниях.
Протамины и гистоны.
Протамины – низкомолекулярные белки, содержащие 60-85% аргинина и обладающие основными свойствами. Хорошо растворяются в воде, кислой и нейтральной среде и осаждаются в щелочных средах. Обнаружены в ядрах сперматозоидов у рыб и птиц. В ядрах клеток находятся в комплексе с ДНК.
Гистоны - белки основного характера с небольшой молекулярной масой. В их состав входят лизин и аргинин, содержание которых не превышает
20-30%. Существует пять различных типов гистонов: H1, H2A, H2B, H3 и H4. Гистоны находятся в основном в ядрах клеток, являются оструктурным компонентом хроматина и необходимы для регуляции экспрессии генов.
Проламины и глютелины.
Проламины - белки растительного происхождения. Содержат 20-25% глутаминовой кислоты и 10-15% пролина. Растворимы в 60-80% водном растворе этанола (тогда как все прочие простые белки в этих условиях обычно осаждаются).
Глютелины - простые белки, содержатся в зеленых частях растений, в семенах злаков. Характеризуются высоким содержанием глутаминовой кислоты и наличием лизина. Растворимы в разбавленных растворах щелочей. Глютелины являются запасными белками.
СЛОЖНЫЕ БЕЛКИ
1. Хромопротеины(от греч. chroma - краска) сложные белки, состоящие из простого белка и связанного с ним небелкового окрашенного компонента. Различают гемопротеины и флавопротеины. Хромопротеины участвуют в процессе дыхания, окислительно-восстановительных реакциях, транспорте кислорода и диоксида углерода, свето- и цветовосприятии и др.
К группе гемопротеинов относятся гемоглобин, цитохромы, миоглобин, каталаза, пероксидаза. Все гемопротеины содержат железопорфирины, но различаютсяе по составу и структуре белковой части, и выполняют различные биологические функции. Так, различия гемоглобина различных биологических видов обусловлены различиами в структуре глобина.
Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем- пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX (рис. 6). В центре гема расположен ион железа в степени окисления +2, связанный с двумя атомами азота ковалентными связами и с двумя другими атомами азота - координационными связями. Вокруг гемма «обернута» полипептидная цепь. Железо в гемоглобине соединяется с атомом азота имидазольной группы гистидина молекулы белка пятой координационной связью. Шестая координационная связь железа используется для присоединения кислорода или других лигандов (рис. 7).
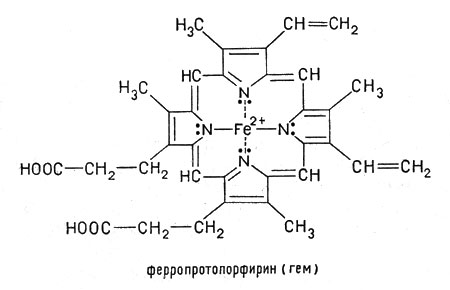 | 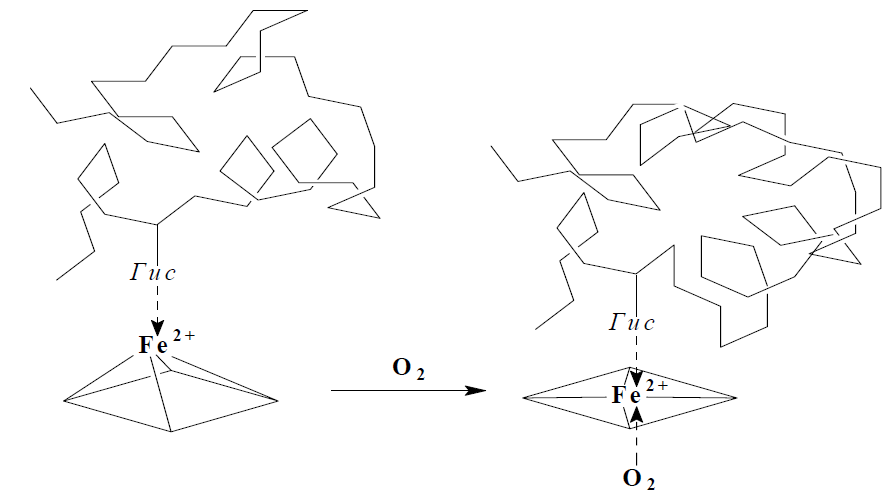 |
| Рис. 6. Гем | Рис. 7. Координационные связи Fe2+ в геме |
Гемоглобин взрослого человека НbА (от англ. аdult - взрослый) имеет четыре полипептидные цепи, составляющие глобин (рис. 8) - белковую часть молекулы. Две α-цепи содержат по 141 аминокислотному остатку, две β-цепи - по 146.
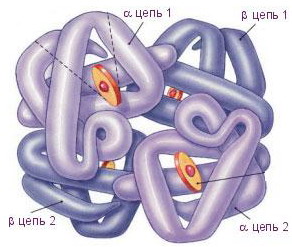 Рис. 8. Гемоглобин Рис. 8. Гемоглобин |
В крови взрослого человека присутствуют также гемоглобин НbА2 (2α-, 2δ-цепи, 2,5%) и НbA3 (менее 1%, отличается строением b-цепи).
Фетальный гемоглобин (гемоглобин плода и новорожденных) HbF состоит из 2α- и 2γ-цепей. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объему крови плода выполнять функцию снабжения кислородом более эффективно. Кровь новорожденного содержит до 80% HbF, к концу 1-го года жизни фетальный гемоглобин почти полностью заменяется на НbА.
Гемоглобинозы – болезни гемоглобинов.
1. Гемоглобинопатии. В их основе лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов аномальных гемоглобинов. Ониразличаются по физико-химическим свойствам (растворимость, электрофоретическая подвижность, изоэлектрическая точка, способность связывать кислород).
Пример гемоглобинопатии - серповидно-клеточная анемия. Заболевание распространено в странах Южной Африки, Южной Америки и Юго-Восточной Азии. Химический дефект - замена глутаминовой кислоты в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина, что является результатом мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода пимеют форму серпа. Отдавая кислорода в тканях, HbS превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде тактоидов (веретенообразных кристаллов). Тактоиды деформируют клетку и приводят к гемолизу. Гетерозиготная форма заболевания протекает бессимптомно либо сопровождается легкой гемолитической анемией. У гомозиготных особей тяжелая форма серповидноклеточной анемии развивается с первых месяцев жизни. Болезнь протекает остро, и дети часто умирают в раннем возрасте.
Примерами аномальных гемоглобинов являются также гемоглобин С (в b-цепи на 6 месте вместо глутаминовой кислоты находится лизин) и гемоглобин D (в b-цепи на 28 месте вместо глутаминовой кислоты находится лейцин). Данные мутации обнаружены в основном в Африке.
2. Талассемии - группа заболеваний с наследственным нарушением синтеза одной из цепей глобина. Различают α-талассемии, когда не происходит синтез α-цепи, и β-талассемии (не синтезируются β-цепи). Гемоглобинопатия Н (один из вариантов a-талассемии) характеризуется гемолитической анемией, выпадением в осадок гемоглобина Н, спленомегалией, тяжелыми изменениями костей.
3. Железодефицитные анемии – заболевания, возникающие при нарушение синтеза гемоглобина вследствие дефицита железа. Основными причинами железодефицитных анемий являются кровопотери, а также недостаток богатой железом пищи - мяса и рыбы.
