Техника проведения посевов. Этапы выделения чистой культуры
Цель занятия. Изучить методы посева бактерий на плотные и жидкие питательные среды, а также способы выделения чистых культур.
Задание: записать этапы и зарисовать схему посева культур микроорганизмов из пробирки в пробирку с помощью бактериологической петли, а также пересева культур микроорганизмов, выращенных на жидких питательных средах, в стерильные питательные среды. Выписать выделенные термины, ответить на вопросы, сделать вывод.
В лабораторных условиях микроорганизмы выращивают на твердых и жидких средах в пробирках, колбах или в чашках Петри. Перед выделением чистой культуры из различных объектов окружающей среды (пищевого продукта, с поверхности плодов и овощей, из почвы, воды и др.), в которых находится множество микроорганизмов, вначале получают накопительные культуры, проводя культивирование в элективных условиях - условиях, способствующих развитию одной культуры и ограничивающих развитие сопутствующих микроорганизмов.
Для выделения чистых и накопительных культур из различных объектов в лабораториях используют методы посева и пересева.
Посевом в микробиологии называют внесение клеток микроорганизмов (посевного материала — инокулята) в стерильные среды.
Пересев - это перенос выращенной культуры микроорганизмов на питательной среде на другую свежую питательную среду. Посев (и пересев) микроорганизмов проводят при соблюдении определенных правил стерильности, которые необходимо выполнять, чтобы предохранить исследуемую культуру от загрязнения посторонними организмами и не загрязнять окружающую среду исследуемыми культурами микроорганизмов.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Для получения накопительных культур используют жидкие накопительные питательные среды, различные методы обработки материала, содержащего смесь микробов, а также учитывают другие особенности выделяемых из объекта микроорганизмов.
Получают накопительные культуры микроорганизмов, используя различные методы. К таким методам относятся методы обогащения, метод нагревания исследуемого материала для выделения спорообразующих бактерий, метод выделения подвижных форм бактерий (метод Шукевича) и др.
Чистой культурой называют культуру, состоящую из микроорганизмов одного вида. Чистая культура микроорганизмов, которая является потомством одной единственной клетки, называется клоном.Существует несколько методов получения чистых культур. Все они основаны на выделении из популяции одной клетки.
МЕТОДЫ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Методы обогащения
Их часто применяют для выделения чистых культур микроорганизмов (например, бактерий группы кишечной палочки (БГКП), сальмонелл и др.) из материалов, в которых мало выделяемых микроорганизмов, но содержится большое количество сопутствующей микрофлоры. Для увеличения численности выделяемого вида микроорганизмов вначале делают посев исследуемого материала в накопительные питательные среды, которые содержат вещества, стимулирующие его рост и угнетающие или задерживающие размножение сопутствующей микрофлоры. Например, для выделения сальмонелл проводят посев в среды обогащения Кауфмана, Мюллера и др., для выделения БГКП – на среду Кесслера. При выделении культур молочнокислых бактерий из почвы, сырого молока или растений посевы делают на стерильное обезжиренное молоко, содержащее 5 % этилового спирта для подавления роста гнилостных бактерий.
Метод нагревания
Применяют для выделения чистых культур споровых форм бактерий (бацилл, клостридий). В этом случае перед посевом исследуемый материал прогревают на водяной бане при температуре 75…85 0С в течение 20…30 мин. Вегетативные формы погибают во время прогревания, а споры микробов остаются живыми и при последующих высевах на плотную среду прорастают, формируя колонии.
Метод выделения подвижных форм бактерий (метод Шукевича)
Заключается в посеве исследуемого материала в конденсационную воду скошенного мясопептонного агара. При размножении подвижные формы микроорганизмов из конденсационной воды распространяются на агаре, как бы вползая на его поверхность.
Методы выделения анаэробных микроорганизмов
Основаны на выращивании микроорганизмов в средах с низкой концентрацией кислорода или в безкислородной среде, что достигается:
посевом исследуемого материала в среды, содержащие редуцирующие и легко окисляемые вещества (антиоксиданты). В качестве таких веществ чаще всего используют тиогликолят натрия, солянокислый цистеин, кусочки животных и растительных тканей;
посевом исследуемого материала в глубину плотных питательных сред. Посев делается уколом препаровальной иглой в пробирку со столбиком плотной среды или в расплавленную плотную или полужидкую питательную среду с последующим перемешиванием;
механическим удалением воздуха из сосудов при выращивании анаэробных микроорганизмов (создают вакуум);
культивированием анаэробных микроорганизмов в жидких средах под слоем масла;
культивированием анаэробных микроорганизмов в атмосфере инертного газа, диоксида углерода, азота.
ТЕХНИКА ПРОВЕДЕНИЯ ПОСЕВОВ
Посев на плотные среды в чашки проводят несколькими способами.
Поверхностный способ посева удобен для посева микроорганизмов из жидкой суспензии на твердую среду. Метод применяется для определения числа жизнеспособных клеток в пробе после серийных разведений. Его можно использовать также для получения сплошного «газона» микроорганизмов на поверхности агара после густого посева. Это удобно при анализе активности ингибиторов, таких как антибиотики или дезинфицирующие вещества, которые добавляют в сделанные в агаре углубления либо наносят на диски из фильтровальной бумаги, размещенные на поверхности агара. Ингибитор диффундирует через агар, образуя зону подавления роста вокруг отверстий или дисков фильтровальной бумаги, которая видна после инкубации. Диаметр зоны может служить мерой степени ингибирования.
Для переноса пробы из жидкой среды, например воды, молока или бульона, в пробирку с питательной средой используют проволочную петлю. Петлю погружают в среду и мягко взбалтывают ее, не забывая каждый раз прокаливать горлышко флакона.
Последовательность действий:
Готовят в чашках Петри твердые пластинки из питательной среды. Стерильную твердую питательную среду расплавляют на водяной бане в пробирке или колбе и охлаждают до температуры 50 °С.
Вынимают чашки Петри из бумаги, в которой они стерилизовались, и ставят их на ровную горизонтальную поверхность.
Берут пробирку или колбу с охлажденной до 50 °С питательной средой, вынимают ватную пробку, обжигают на пламени горелки края пробирки и держат ее в наклонном положении. Приоткрывают крышку чашки Петри левой рукой, а правой рукой наливают среду на дно чашки Петри, заполняя всю ее поверхность.
Оставляют чашку Петри на столе до полного застывания среды, затем ставят в термостат на 15-20 мин для подсушивания.
На твердую среду посевной материал наносят петлей или пипеткой. Затем каплю посевного материала равномерно распределяют по поверхности, пользуясь стерильным шпателем (изогнутой стеклянной палочкой). Для этого, шпатель вынимают из бумаги и берут в правую руку.
Приоткрывают крышку чашки Петри левой рукой и вносят в нее шпатель.
Размазывают каплю посевного материала шпателем вращательными движениями по поверхности агаровой пластинки (надавливать шпателем на твердую среду не следует, так как можно ее повредить).
Переносят шпатель в сосуд с дезинфицирующим раствором.
Посев заливкой - метод, альтернативный методу посева на поверхность агара, используется для инокуляции клеток из жидкой культуры, а также для подсчета жизнеспособных клеток. Поскольку клетки распределены по всей среде, а не только по поверхности агара, можно подсчитать гораздо большее их количество - до 1000 колоний на чашку. Однако размеры выросших колоний значительно меньше.
Для этого, определенный объем (до 0,5 см3) клеточной суспензии вносят в простерилизованный флакон, подходящего объема (около 15- 20 см3) с расплавленным в нем питательным агаром, который предварительно был охлажден до 45—50 °С в водяной бане. Снимают крышку и перед добавлением клеточной суспензии прожигают горлышко флакона. Суспензию клеток тщательно перемешивают с питательным агаром, поворачивая (не встряхивая) назад и вперед зажатый в ладонях флакон. Затем выливают смесь в стерильную чашку Петри. Подписывают донышко чашки и инкубируют ее.
Используется и другой вариант посева в жидкую среду, т.н. глубинный способ посева:
Приоткрывают стерильную чашку Петри и помещают петлей или пипеткой каплю посевного материала на дно чашки.
Расплавляют агаризованную питательную среду в пробирке или колбе и охлаждают ее до 45-48 °С.
Обжигают края пробирки или колбы в пламени горелки и выливают среду в чашку Петри с внесенным посевным материалом, соблюдая правила стерильной работы.
Распределяют равномерно посевной материал в питательной среде, для чего осторожно круговыми движениями перемещают чашку Петри по поверхности стола.
Оставляют чашку Петри на столе до полного застывания среды.
Делают на чашке Петри надпись (число, название микроорганизма).
Посев уколом используют для культивирования анаэробных организмов или организмов, растущих при низкой концентрации кислорода (микроаэрофилов). Обычно используют пробирку с питательной агаризованной средой. Благодаря небольшой поверхности и достаточно большой глубине агара в пробирке по сравнению с чашкой доступ кислорода внутрь агара ограничивается. Посев производят прямой проволочкой (без петли), или бактериологической иглой. Небольшое количество культуры (твердой или жидкой) берут кончиком иглы и затем вертикально прокалывают ею агар. Культура растет в агаре во все стороны от линии прокола.
Все посевы, выполненные описанными способами, помещают в термостат для выращивания микроорганизмов при температуре, благоприятной для их роста.
Далее производят пересев культуры.
Пересев микроорганизмов, выращенных на твердой среде в пробирках, в другие пробирки со средой выполняется в определенной последовательности:
На пробирке со свежей питательной средой разборчиво подписывают название микроорганизма, ставят дату посева. Надписи делают чернилами по стеклу или стеклографом.
Зажигают горелку. Посевы проводят над пламенем горелки, чтобы теплый воздух препятствовал осаждению микроорганизмов из окружающего воздуха и отчасти их уничтожал.
Берут и правую руку бактериологическую петлю, с помощью которой осуществляют посев (петлю держат как карандаш).
Стерилизуют бактериологическую петлю в пламени горелки, прокаливая проволоку докрасна, и одновременно обжигают примыкающую к петле часть держателя, который будет вводиться в пробирку с культурой микроорганизмов. При прокаливании петлю держат в пламени почти вертикально, чтобы вся проволока была раскалена.
Берут в левую руку две пробирки: одну со стерильной средой (дальше от себя), другую — с культурой микроорганизмов (ближе к себе).
Не выпуская бактериологической петли в правой руке, мизинцем и безымянным пальцем правой руки прижимают наружные концы ватных пробок к ладони и вынимают пробки из пробирок. Класть пробки па стол нельзя.
Слегка обжигают в пламени горелки края открытых пробирок.
Вводят в пробирку с культурой микроорганизмов петлю. Чтобы не повредить клетки микроорганизмов, петлю вначале охлаждают, прикасаясь к внутренней поверхности пробирки или к питательной среде, свободной от клеток микроорганизмов, и только после этого отбирают небольшое количество микробной массы.
Вынимают петлю и вводят ее в пробирку со стерильной питательной средой, избегая прикосновения со стенками пробирки.
Проводят петлей от дна вверх зигзагообразную или прямую черту-штрих, слегка касаясь поверхности агара.
Обжигают ватные пробки и края пробирок одновременно в пламени и закрывают обе пробирки.
Обжигают петлю в пламени.
Пересев культур микроорганизмов, выращенных в жидкой среде, выполняется с учетом особенностей характеристик среды:
Из стерильной бумаги вынимают градуированную стерильную пипетку за верхний конец. Берут пипетку средним и большим пальцами правой руки, не касаясь поверхности той части пипетки, которая будет вводиться в сосуд с жидкой средой.
Берут в левую руку пробирку (или колбу) с культурой микроорганизмов, выращенной в жидкой среде, и держат ее в вертикальном положении, чтобы не замочить пробку.
Открывают пробку, соблюдая все правила стерильности, описанные выше, и вводят пипетку в пробирку.
Набирают в пипетку суспензию микроорганизмов, закрывают пробкой пробирку (или колбу), вносят определенное количество суспензии в свежую стерильную питательную среду, соблюдая описанные правила предосторожности.
Пипетку помещают в сосуд с дезинфицирующим раствором (0,5-3%-м водным раствором хлорамина или 3-5%-м водным раствором фенола), не касаясь ею окружающих предметов.
При использовании этих методов иногда получаются не чистые, а смешанные культуры. Это является результатом того, что колонии могут образоваться не из одной, а из двух или нескольких клеток, попавших в одну точку. Поэтому метод выделения чистых культур требует двух- или трехкратного повторения выделения культур из одной колонии. Для выделения чистых колоний бактерий из смеси бактерий применяют посев на твердую среду штрихом, или посев разведением. Для выделения чистых культур многих бактерий используют МПА, для дрожжей — сусло-агар.
Метод разбавления Пастера (метод предельных разведений)
Заключается в том, что из исследуемого материала делают ряд последовательных разведений в жидкой питательной среде. Для этого каплю посевного материала вносят в пробирку со стерильной жидкой средой, из нее каплю переносят в следующую пробирку и так засевают до 8…10 пробирок. С каждым разведением количество микробных клеток, попадающих в среду, будет уменьшаться и можно получить такое разведение, в котором во всей пробирке со средой будет находиться только одна микробная клетка, из которой разовьется чистая культура микроорганизма. Так как в жидких средах микробы растут диффузно, т.е. легко распределяются во всей среде, то изолировать одну микробную клетку от другой трудно. Таким образом, метод Пастера не всегда обеспечивает получение чистой культуры. Поэтому в настоящее время этот метод используется, главным образом, для предварительного уменьшения концентрации микроорганизмов в материале перед посевом его в плотную среду для получения изолированных колоний.
Капельный метод выделения чистой культуры из одной клетки
Предварительно подготавливается разведение культуры микроорганизма в питательной среде с таким расчетом, чтобы в небольшой капле этой среды могли быть единичные клетки. Затем на поверхность стерильного стекла с помощью стерилизованной иглы и стеклянной палочки наносят ряды мелких капель среды, содержащей микроорганизмы.
Стекло переворачивают и помещают над лункой предметного стекла. Края лунки предварительно обмазывают вазелином. Затем все капли просматривают под микроскопом и отмечают те из них, в которых находится только одна клетка.
Стекло помещают в чашку Петри, на дне которой находится увлажненная фильтровальная бумага, и ставят в термостат; клетка размножается, образуя микроскопическую колонию.
Полученную колонию снимают стерильной фильтровальной бумагой, которую держат стерилизованным на пламени пинцетом, и переносят в пробирку с питательной средой. Выделение чистой культуры капельным методом используется при работе с крупными микроорганизмами (дрожжами, плесенью).
Метод выделения чистой культуры с помощью твердых сред (метод Коха и метод Дригальского)
Наиболее распространенный в микробиологической практике метод основан на том, что при нанесении микроорганизмов из посевного материала на твердую среду отдельные клетки будут закрепляться (иммобилизоваться) в определенной точке твердой среды и, размножаясь, давать потомство (клон), представляющее чистую культуру микроорганизма.
Для получения изолированных колоний на твердой среде на поверхность твердой питательной среды исследуемый материал высевают, каплю его наносят петлей или пипеткой.
Рассев проводят либо методом истощающего мазка, либо методом истощающего штриха.
В первом случае шпателем равномерно распределяют нанесенную каплю по поверхности твердой среды. Тем же шпателем делают посев на поверхности второй пластинки и затем третьей, т. е. переносят последовательно на твердую среду клетки микроорганизмов, которые остались на шпателе.
Таким образом, количество микроорганизмов, вносимых последовательно на пластинки, будет уменьшаться: на вторую пластинку - меньше, чем на первую; на третью - еще меньше, чем на вторую, и т. д.
При использовании метода истощающего штриха исследуемый материал наносят петлей в верхнюю часть твердой среды в чашке Петри и аккуратно, зигзагообразно петлей по поверхности чашки. Затем посев проводят аналогично на второй и третьей чашках.
После посева чашки необходимо перевернуть вверх дном и поставить в термостат при температуре, благоприятной для данного микроорганизма. Инкубируют посевы обычно в термостате в течение 2-3 дней. В результате на поверхности среды вырастают колонии микроорганизмов. Выросшие колонии сначала рассматривают невооруженным глазом, а затем при помощи лупы или при малом увеличении микроскопа.
а 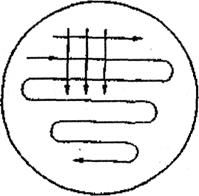 б
б 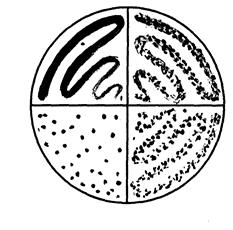
Рисунок 1. а -метод посева зигзагообразной петлей; б – метод посева истощающего штриха
Может наноситься серия штрихов (рис. 2). При этом, проводя на поверхности среды штрихи, после каждой серии чашку немного поворачивают, так чтобы в каждой новой серии распределялись бактерии из предыдущей серии штрихов, истощая, таким образом штрихи до отдельных бактерий.
С помощью этого метода можно выделять бактерии из естественных мест обитания, например из почвы, молока, воды. Образцы твердых субстанций, таких как почва, лучше суспендировать в небольшом количестве воды, либо предварительно проинкубировать в жидкой среде. Безопасным источником для рутинной работы является пастеризованное молоко. Перед тем как проводить эксперименты с бактериями или грибами, следует ознакомиться с инструкциями и правилами безопасности, чтобы снизить до минимума риск культивирования вредных организмов.
Из отобранных колоний готовят препараты, микроскопируют их (рассматривают под микроскопом) для проверки морфологической однородности клеток. Рассматривают препараты с объективом х 90 при максимальном освещении. При приготовлении препаратов необходимо соблюдать все правила стерильности (не открывать широко крышку чашки, хорошо стерилизовать петлю).
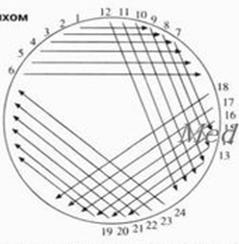
Рисунок 2. Каждая линия обозначает один штрих проволочной петлей
