Гниение белков и обезвреживание его продуктов
Гниение белков – это бактериальный распад белковых веществ и АК под действием микрофлоры кишечника. Идет в толстой кишке, однако может наблюдаться и в желудке – при снижении кислотности в нем.
Образуются такие продукты:
а) токсичные: сероводород H2S, углекислота CO2, аммиак NH3, метан CH4, меркаптаны (CH3SH и его гомологи), бензол C6H6, крезол, индол, скатол и др.
б) нетоксичные: спирты (в т.ч. этиловый), амины, жирные к-ты, кетокислоты, витамины (напр., витамин B6).
Основные процессы гниения:
1. Декарбоксилирование (–СО2) обычно характерно для диаминомонокрбоновых кислот.
Напр., орнитин COOH-CH(NH2)-CH2-CH2-CH2-NH2 превращается в путресцин (то же, но без СООН-группы). Или лизин (ЛИЗ) – в кадаверин (это вроде первой реакции, но в цепи на одну CH2-группу больше).
Путресцин, кадаверин входят в состав трупных ядов. Они всасываются и частично выводятся с мочой и обезвреживаются в печени диаминооксидазой.
2. Дезаминирование. При гниении главным образом протекает восстановительное дезаминирование. Напр., аланин (АЛА) NH2-CH(CH3)-COOH + 2Н → СН3-СН2-СООН (пропионовая к-та) +NH3.
3. Десульфирование (тоже восстановительное).
Напр., цистеин (ЦИС) NH2-CH(CH2SH)-COOH + 2Н → АЛА + H2S.
Напр., метионин (МЕТ) NH2-CH(CH2-СН2-S-CH3)-COOH + 2Н → NH2-CH(CH2-CH3)-COOH (альфа-аминомасляная к-та) + НS-CH3 (метил-меркаптан).
4. Разрушение боковой цепи АК (ТИР, ТРИ).
Напр., тирозин (ТИР) + 4Н → крезол (пара-метилфенол) + NH3 + CO2 + CH4; крезол + 2Н → фенол + СН4.
Напр., триптофан (ТРИ) + 4Н → скатол (метилиндол) + NH2 + CO2 + CH4. Скатол +2Н→ индол + СН4.
Т.о., в процессе гниения АК образуются различные токсичные вещества, которые должны быть обезврежены в печени. В обезвреживании участвуют две системы:
1) УДФГК – уридиндифосфоглюкуроновая к-та (активная форма глюкуроновой к-ты)

2) ФАФС – 3'-фосфоаденозин-5’-фосфосульфат (активная форма серной к-ты) [рис. этого соединения].
Механизм обезвреживания – конъюгация (связывание) токсина с активной формой серной или глюкуроновой к-ты. Продукты конъюгации – нетоксичные вещества, которые могут выделяться с мочой.
Напр., обезвреживание фенола под действием УДФ-глюкуронил-трансферазы: фенол + УДФГК → (ТФ) фенилглюкуронид (фенил присоединяется по первому положению) + R-OH.
Напр., обезвреживание индола: Индол окисляется кислородом по 7-му положению, получается индоксил (это типа 7-оксииндол). Индоксил взаимодействует с ФАФС под действием арилссульфо-трансферазы с образованием индоксилсерной к-ты, которая с ионами калия дает индикан (калиевая соль индоксилсульфата).

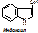
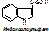
Определение индола и индикана в моче имеет диагностическое значение. Так, если отсутствует индол, то обезвреживающая функция печени в норме, а если при этом обнаруживается индикан, то в кишечнике активное гниение. Если же есть индол в моче, то имеется нарушение обезвреживающей функции печени.
Метаболизм аминокислот
Фонд АК организма пополняется за счет процессов:
1) гидролиза белков пищи,
2) гидролиза тканевых белков (под действием катепсинов лизосом).
Расходуется АК-фонд на процессы:
ü синтез заменимых АК,
ü синтез собственных белков,
ü синтез азотсодержащих веществ (урины, пиримидины, холин, креатин и т.д.),
ü синтез углеводов (глюконеогенез),
ü синтез липидов из кетогенных АК,
ü распад до NH3, NH2-CO-NH2, мочевой к-ты и др.
Условно метаболизм АК в тканях можно распределить на общие пути и индивидуальные пути обмена АК.
Общие пути обмена веществ
1. Переаминирование (открыто в 1937 г. Браунштейном и Крицмом).
Роль: синтез заменимых АК, участие в непрямом дезаминировании АК. Определение АлАТ и АсАТ в крови имеет большое диагностическое значение. Так, через 5 часов после инфаркта миокарда АсАТ увеличивается в 20-30 раз, через 48 часов – АлАТ и АсАТ снижаются до нормы, еще через 24 часа повышается АлАТ. Также АлАТ повышается при патологии печени.
2. Дезаминирование (ДА) АК:
ü восстановительное ДА – под действием микрофлоры кишечника,
ü гидролитическое ДА – с участием воды,
ü внутримолекулярное ДА – с образованием непредельной к-ты,
ü окислительное ДА – характерно для тканей организма. Оно бывает прямым и непрямым.
Прямое ДА идет с участием дезаминаз (оксидаз). NH2-CHR-COOH → NH=CR-COOH (иминокислота), при этом ФМН→ФМН·Н2, который затем восстанавливает кислород до пероксида водорода; последний расщепляется каталазой. А иминокислота гидролизуется до альфа-кетокислоты и аммиака.
Непрямое ДА (или транс-ДА) идет в два этапа: 1) переаминирование (см. выше); 2) дезаминирование ГЛУ «α-КГ + NH3, над стрелочкой глутамат-ДГ, под стрелочкой – НАД→НАД·Н2.
3. Декарбоксилирование АК – процессы образования биогенных аминов, обладающих биологической активностью:
ГИС → (гистидил-ДК, ПФ) гистамин,
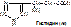

ТИР → (оксигеназа, +1/2О2) ДОФА (диоксифенилаланин) → (ДК, ПФ, -СО2)дофамин,




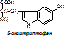
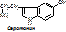
ТРИ → (оксигеназа, +1/2О2) 5-окситриптофан → (ДК, ПФ, -СО2) серотонин,
ГЛУ → гамма-аминомасляная к-та (ГАМК).

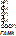
Дофамин и ГАМК – тормозные нейромедиаторы, гистамин – тканевой гормон. Серотонин является местным регулятором в функции периферических органов.
Образование конечных азотистых продуктов
В сутки распадается около 1-2% всех белков организма, что составляет в среднем 500 г. Из них 80% (400 г) идут на ресинтез организм-специфичных белков, а 20% (100 г) подвергаются непрямому дезаминированию с образованием конечных продуктов – кетокислот и аммиака (они содержат 10-16 г азота).
