Биологические факторы повреждения
К ним относят главным образом инфекционные агенты и цитотоксические факторы системы ИБН.
Инфекционные агенты (вирусы, риккетсии, микробы, гельминты, грибы, при-оны) как сами по себе, так и в виде продуктов их жизнедеятельности или деградации вызывают расстройства функций клетки, нарушают течение в ней метаболических реакций, проницаемость или даже целостность мембран, подавляют активность клеточных ферментов.
К цитотоксическим факторам системы ИБН относятся эндо- и экзотоксины, аутоагрессивные Т-лимфоциты, в ряде случаев — AT (например, при явлениях молекулярной мимикрии).
ГЕНЕЗ ПОВРЕЖДАЮЩИХ ФАКТОРОВ
Причины повреждения клеток классифицируют в зависимости от их происхождения на экзогенные или эндогенные, инфекционные или неинфекционные.
Экзогенными факторами повреждения являются физические воздействия (механические травмы, электрический ток, тепло, холод), химические агенты (кислоты, щёлочи, этанол, сильные окислители) и биологические факторы (вирусы, риккетсии, бактерии, гельминты и др.).
К эндогенным факторам повреждения относятся агенты физической природы, химические факторы, факторы биологической природы.
Примерами инфекционно-паразитарных факторов могут быть эндо- и экзотоксины микроорганизмов, много- и одноклеточные паразиты.
К факторам неинфекционного генеза относятся агенты физической, химической или биологической (но неинфекционной) природы.
ЭФФЕКТЫ ПОВРЕЖДАЮЩИХ ФАКТОРОВ
Действие повреждающих факторов на клетки осуществляется прямо (первичные факторы повреждения) или опосредованно. В последнем случае речь идет о формировании цепи вторичных реакций, реализующих повреждающее влияние так называемых первичных патогенных факторов.
Общие механизмы повреждения.
Расстройства энергетического обеспечения клетки:Снижение интенсивности и/или эффективности ресинтеза АТФ, Нарушение транспорта энергии АТФ, Нарушение использования энергии АТФ.
Повреждение мембран и ферментов клетки: Чрезмерная интенсификация свободнорадикальных реакций и СПОЛ, Значительная активация гидролаз, Внедрение амфифильных соединений в липидную фазу мембран и их детергентное действие, Торможение ресинтеза повреждённых компонентов мембран и/или синтеза их de novo, Нарушение конформации макромолекул белка, ЛП, фосфолипидов, Перерастяжение и разрыв мембран набухших клеток и/или их органелл.
Дисбаланс ионов и воды в клетке: Изменение соотношения отдельных ионов в цитозоле, Нарушение трансмембранного соотношения ионов, Гипергидратация клеток, Гипогидратация клеток, Нарушения электрогенеза.
Нарушения в геноме и/или механизмов экспрессии генов: Мутации, Дерепрессия патогенных генов, Репрессия жизненно важных генов, Трансфекция (внедрение в геном чужеродной ДНК), Дефекты транскрипции, процессинга, трансляции, посттрансляционной модификации, Дефекты репликации и репарации, Нарушение митоза и мейоза
Расстройства регуляции функций клеток:Рецепции регулирующих факторов, Образования вторых посредников, Регуляции метаболических процессов в клетке
№ 17 Типовые формы патологии клеток: виды, основные причины, механизмы развития, проявления, последствия.
Дистрофии. Клеточные дистрофии — нарушения обмена веществ, сопровождающиеся расстройством функций клеток, пластических процессов в них, а также структурными изменениями, ведущими к нарушению жизнедеятельности клеток.
Механизмы дистрофий разнообразны. К числу ведущих относятся следующие:
• синтез аномальных, в норме не встречающихся в клетке, веществ (например, белково-полисахаридного комплекса — амилоида);
• избыточное превращение одних соединений в другие (например, жиров и углеводов в белки, углеводов в жиры);
• декомпозиция (фанероз): распад субклеточных структур и/или веществ (например, белково-липидных комплексов мембран);
• инфильтрация клеток и межклеточного вещества органическими и неорганическими соединениями (например, ЛПНП и Са2+ клеток интимы артерий при атеросклерозе).
Виды клеточных дистрофий.
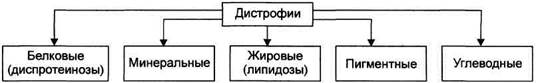
Основным критерием классификации клеточных дистрофий является преимущественное нарушение метаболизма отдельных классов веществ. Согласно этому, различают диспротеинозы (белковые дистрофии), липидозы (жировые дистрофии), диспигментозы (пигментные дистрофии), углеводные и минеральные дистрофии. Отдельную группу составляют тезаурисмозы (болезни накопления).
ДИСПРОТЕИНОЗЫ
Для белковых дистрофий характерно изменение физико-химических свойств клеточных белков и как следствие — нарушение их ферментативной и структурной функций. Различают зернистую, гиалиново-капельную и гидропичес-кую дистрофии. Эти разновидности диспротеинозов — последовательные этапы нарушений обмена белков, приводящие к некрозу клеток.
Чаще диспротеинозы являются приобретёнными (вторичными). Реже встречаются первичные (наследуемые и врождённые) их варианты. Обычно эти последние — результат ферментопатий и обусловлены нарушениями обмена аминокислот, например цистеина (цистиноз), фенилпировиноградной кислоты (фе-нилкетонурия), тирозина (тирозиноз) и некоторых других.
ЛИПИДОЗЫ
К липидам относят различные по химическому составу гидрофобные вещества.
Для липидозов (жировых дистрофий) характерно увеличение содержания внутриклеточных липидов, появление липидов в клетках, где они в норме отсутствуют, а также образование липидов аномального химического состава.
Различают липидозы первичные (наблюдаются, как правило, при ферментопа-тиях: ганглиозиддипидоз, цереброзидлипидоз, сфингомиелинлипидоз и др.) и вторичные (вызванные различными патогенными факторами: этанолом, соединениями фосфора, четырёххлористым углеродом, некоторыми ЛС — цито-статиками, антибиотиками, барбитуратами и др.). Вторичные липидозы, подобно диспротеинозам, наиболее часто выявляются в клетках миокарда, печени, почек, мозга и носят соответствующие названия (жировая дистрофия сердца, печени, почек, мозга).
УГЛЕВОДНЫЕ ДИСТРОФИИ
Углеводные дистрофии характеризуются нарушениями обмена полисахаридов (гликогена, мукополисахаридов) и гликопротеинов (муцина, мукоидов).
ДИСПИГМЕНТОЗЫ
Клеточные пигменты — хромопротеиды — соединения, состоящие из белка и хромофора.
Виды пигментов: гемоглобиногенные, или железозависимые; протеиногенные, или тирозиногенные;липидогенные, или липопротеиногенные.
Виды диспигментозов. Пигментные дистрофии (диспигментозы) классифицируют в зависимости от их происхождения, механизма развития, структуры пигмента, проявлений и распространённости.
МИНЕРАЛЬНЫЕ ДИСТРОФИИ
Из минеральных дистрофий наибольшее значение имеют нарушения обмена кальция, калия, железа, цинка, меди в виде отложения солей этих химических элементов.
ТЕЗАУРИСМОЗЫ
Тезаурисмозы (болезни накопления) — накопление избытка различных веществ в клетках, что сопровождается нарушением их структуры и функции, а также интенсивности и характера метаболических и пластических клеточных процессов. Практически все тезаурисмозы — результат наследственных ферментопатий, передающихся, как правило, по аутосомно-рецессивному типу. В отдельные группы принято выделять болезни накопления лизосомные и пероксисомные. В зависимости от типа накапливающихся веществ тезаурисмозы подразделяют на липидные (липидозы), гликогеновые (гликогенозы), аминокислотные, нуклеопротеиновые, мукополисахаридные (мукополисахаридозы), муколипидные (муколипидозы). Наиболее распространёнными разновидностями тезаурисмозов являются липидные и гликогеновые.
Дисплазии. ДИСПЛАЗИИ- нарушения дифференцировки клеток, сопровождающиеся стойкими изменениями их структуры, метаболизма и функции, ведущими к нарушению их жизнедеятельности
Дифференцировка клеток определяется генетической программой, но реализация этой программы в существенней мере зависит от сложных взаимодействий ядра и цитоплазмы, микроокружения клетки, влияния на клетку БАВ и многих других факторов. Именно поэтому даже при одном и том же отклонении в геноме различных клеток проявления дисплазии могут носить «разноликий» характер. Среди дисплазии выделяют метаплазии, характеризующиеся замещением в конкретном органе характерных для него клеток клетками другого типа.
Существенно, что клеточные дисплазии лежат в основе опухолевого роста и в клинической практике рассматриваются как предраковые состояния.
Как правило, при дисплазиях клетки увеличены в размерах, имеют неправильную, причудливую форму («клетки-монстры»), соотношение различных орга-нелл в них диспропорционально. Нередко в таких клетках обнаруживаются различные включения и признаки дистрофических процессов.
№ 18 Гибель клеток: некроз и апоптоз, их виды, причины, стадии, механизмы развития, различие и значение.
Известно два качественно различных варианта смерти клеток: некроз и апоптоз.
НЕКРОЗ
Некроз — собственно смерть повреждённой клетки, сопровождающаяся необратимым прекращением её жизнедеятельности. Некроз является завершающим этапом клеточных дистрофий или следствием прямого действия на клетку повреждающих факторов значительной (разрушающей) силы. Некроз, как правило, сопровождается воспалительной реакцией.
Паранекроз и некробиоз. Некрозу предшествуют паранекроз (метаболические и структурные изменения ещё обратимы) и некробиоз. На этапе некробиоза патогенные изменения приобретают необратимый характер и приводят к некрозу. Основные звенья патогенеза некроза те же, что и при повреждении клеток, но при развитии некроза они максимально интенсифицированы и развиваются на фоне недостаточности адаптивных механизмов (защиты и регенерации повреждённых структур, компенсации нарушенных процессов в клетке).
Лизис и аутолиз. Некротизированные клетки подвергаются деструкции (лизис) при помощи лизосомных ферментов и свободных радикалов.
• Гидролиз внутриклеточных компонентов и межклеточного вещества происходит под влиянием ферментов лизосом альтерированных клеток. Высвобождению лизосомных ферментов способствует развитие внутриклеточного ацидоза.
• Деструкция повреждённых компонентов клеток осуществляется при участии активных форм кислорода и свободных радикалов. Известны факты интенсификации свободнорадикальных и липопероксидных реакций при остром воспалении, механическом повреждении, на определённых этапах инфаркта (частной формы некроза, развивающегося вследствие нарушения кровоснабжения ткани), опухолевого роста (сопровождается гибелью большого числа как злокачественных, так и окружающих нормальных клеток) и других патологических процессах.
Эти два механизма обеспечивают саморазрушение структур клетки (аутолиз).
Разрушение повреждённых и некротизированных клеток происходит и при участии других клеток — фагоцитов, а также микроорганизмов. В отличие от аутолитического распада, последний механизм обозначают как гетеролитический.
АПОПТОЗ
Апоптоз является другим вариантом гибели клеток. АПОПТОЗ - форма гибели отдельных клеток, возникающая под действием вне- или внутриклеточных факторов, осуществляющаяся путём активации специализированных внутриклеточных процессов, регулируемых определёнными генами.
Таким образом, апоптоз — программированная гибель клетки. В этом его принципиальное отличие от некроза. Другое принципиальное отличие апоптоза от некроза состоит в том, что программу апоптоза запускает информационный сигнал, тогда как некроз клетки развивается под влиянием повреждающего агента. В финале некроза происходит лизис клетки и освобождение её содержимого в межклеточное пространство, тогда как апоптоз завершается фагоцитозом фрагментов разрушенной клетки. Некроз — всегда патология, тогда как апоптоз наблюдается в ходе многих естественных процессов, а также при адаптации клетки к повреждающим факторам. Апоптоз — в отличие от некроза — энергозависим и требует синтеза РНК и белков.
Примеры апоптоза. Запрограммированная гибель клеток; Гибедь клеток, выполнивших свою функцию; Дегенерация; Ликвидация аутоагрессивных Т-клеток; Старение; Трансфекция; Повреждение клетки; Опухолевый рост.
Механизм апоптоза. При реализации апоптоза условно можно выделить четыре стадии.
Стадия инициации. На этой стадии информационные сигналы рецептируются клеткой. Патогенный агент либо сам является сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регулятор-ным структурам и молекулам.
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоп-тозу путём активации исполнительной программы (её эффекторами являются цистеиновые протеазы — каспазы и эндонуклеазы), либо блокируют потенциально летальный сигнал.
Стадия реализации программы. Стадия реализации программы апоптоза (исполнительная, эффекторная) состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство, а при апоптозе отсутствует воспалительная реакция. Этот признак отличает апоптоз от некроза, который сопровождается развитием перинекротического воспаления.
№ 19 Адаптивные процессы в клетке при действии на них повреждающих агентов. Методы повышения устойчивости клеток к повреждению.
Действие на клетку патогенных факторов сопровождается активацией (или включением) различных реакций и процессов, направленных на устранение либо уменьшение степени повреждения и его последствий, а также обеспечивающих устойчивость клеток к повреждению.
ХАРАКТЕР ПОВРЕЖДЕНИЙ КЛЕТОК
Любое повреждение клетки вызывает в ней разной степени выраженности специфические и неспецифические изменения
