Аутосомно-рецессивные заболевания
Аутосомно-рецессивные заболевания проявляются только при гомозиготном носительстве мутантных аллелей. При этом происходит частичная или полная инактивация функции мутантного гена. Одну из мутаций больной ребенок наследует от матери, другую - от отца. Родители больного, будучи сами здоровы, являются гетерозиготными носителми мутации. Вероятность рождения больного ребенка в такой семье в соответствии с законом Менделя составляет 25%. Девочки и мальчики болеют с одинаковой частотой, при этом рождение больного ребенка совершенно не зависит от возраста родителей, очередности беременности и родов. Часто в одной семье может наблюдаться несколько больных сибсов. Две трети здоровых детей в браке гетерозиготных родителей также оказываются гетерозиготными носителями мутации. В браке гетерозиготного носителя рецессивной мутации с супругом, не имеющим мутантного аллеля, все дети будут здоровы, но половина из них окажутся гетерозиготными носителями мутации. Анализ родословных больных с аутосомно-рецессивными заболеваниями показывает, что часто (примерно в 60%) родители таких больных являются родственниками или их предки происходят родом из одного села или района, что так же является косвенным признаком инбридинга.
Муковисцидоз
Самым распространенным аутосомно-рецессивным заболеванием детского возраста среди представителей белой расы является муковисцидоз или кистозный фиброз поджелудочный железы. Впервые заболевание описано в 1938 году американским паталогоанатомом Д. Андерсон. Согласно зарубежной статистике частота муковисцидоза у жителей Западной Европы, в среднем, составляет 1 на 2-3 тысячи новорожденных, в России она меньше - 1 на 3-5 тысяч. Наблюдаются значительные географические и этнические различия по частоте муковисцидоза. В странах Африки и Азии муковисцидоз почти не встречается, тогда как каждый 20-й (5%) житель Западной Европы является гетерозиготным носителем мутации в гене муковисцидоза (CFTR). Такую высокую распространенность мутантных аллелей в гене CFTR связывают как с «эффектом основателя», так и селективным преимуществом гетерозигот, обусловленным устойчивостью к холере, туберкулезу, токсическим формам гриппа. С другой стороны, у гетерозигот вдвое выше частота хронического панкреатита.
Основной патогенетический механизм заболевания - увеличение вязкости секрета, выделяемого слизеобразующими железами бронхов, кишечника, поджелудочной железы, семявыводящих канальцев, сопровождающееся закрытием многих протоков в этих органах. В частности, нарушается естественный процесс очищения бронхов, что приводит к их воспалению. Воспаление сопровождается отеком легких и увеличением продукции аномально вязкого секрета. Повышенная вязкость секрета в желудочно-кишечном тракте сопровождается изменением водно-электролитного компонента панкреатического сока, его сгущением и затруднением выделения в просвет кишечника. В результате нарушается формирование каловых масс с последующей кишечной непроходимостью и происходит фиброзно-кистозное изменение ткани поджелудочной железы.
Минимальными диагностическими симптомами муковисцидоза являются рецидивирующие легочные, чаще всего синегнойные инфекции, нарушение функции кишечника и поджелудочной железы, отставание в физическом развитии. Характерными признаками заболевания считаются большое количество неперевариваемого жира в копрограмме больного и повышение концентрации ионов натрия и хлора при проведении потовой пробы. У некоторых больных уже при рождении наблюдается кишечная непроходимость, обусловленная мекониальным илеусом. Такие больные требуют срочного оперативного вмешательства. Иногда мекониальный илеус у плода с муковисцидозом можно обнаружить при ультразвуковом исследовании уже во 2-3-м триместрах беременности. Выделяют три клинические формы муковисцидоза: легочную (15-20% случаев), кишечную (10%) и смешанную. Описаны также стертые формы заболевания, выявляющиеся у взрослых.
Обследованию на наличие муковисцидоза подлежат следующие группы лиц: (1) больные с рецедивирующими бронхолегочными заболеваниями, синегнойной инфекцией, астмой, аллергозами; (2) лица с заболеваниями желудочно-кишечного тракта (склонные к запорам, колитам, хроническому панкреатиту, рецидивирующей кишечной непроходимости; новорожденные с мекониальным илеусом, перитонитом; дети с большим животом и низкой массой тела (при нормальном аппетите);больные циррозом печени неясного генеза; (3) мужчины с бесплодием после исключения других причин (у 98% мужчин больных муковисцидозом имеется сужение или атрезия семявыводящего протока). Муковисцидоз входит в программу неонатального скрининга новорожденных.
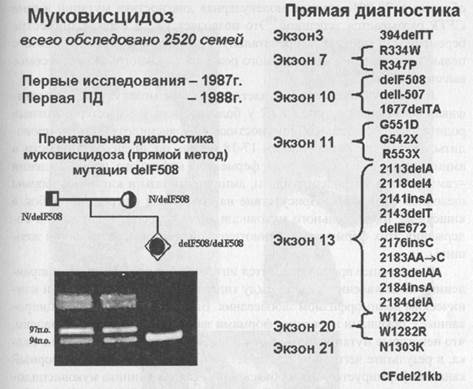
Ген муковисцидоза был картирован в 1985 году в длинном плече хромосомы 7 в области 7q31.2. В 1989 году он был идентифицирован, и это открытие сопровождалось одновременной публикацией в одном из самых престижных журналов мира («Science» - Наука) трех статей. Первая статья была посвящена самому гену муковисцидоза. Группе канадских исследователей под руководством Л. Ч. Тсуи удалось выделить и определить нуклеотидную последовательность кДНК гена муковисцидоза (CFTR). Были определены экзон-интронные границы и регуляторные области гена. Вторая статья была посвящена белку, кодируемому геном CFTR и являющимся первичным биохимическим дефектом у больных муковисцидозом. Оказалось, что этот трансмембранной белок, локализованный на апикальных мембранах экзокринных желез эпителия, участвует в регуляции проводимости ионов хлора и сам выполняет функции хлорного канала. В третьей статье был проведен анализ мутаций в гене CFTR. Как только становится известна нуклеотидная последовательность кодирующей области гена, сразу же можно задаться вопросом, а что случилось у больного, чем ген больного человека отличается от нормального гена? Используя нормальную кДНК гена CFTR в качестве ДНК-зонда, удалось выделить мутантную кДНК из эпителия бронхов девочки, больной муковисцидозом. На следующем этапе была определена полная нуклеотидная последовательность этой кДНК. Оказалось, что больная девочка гомозиготна по специфической мутации в гене CFTR -делеции трех нуклеотидов в 10-м экзоне, сопровождающейся отсутствием фенилаланина в 508 положении соответствующего белка - delF508. Частота этой мутации у больных муковисцидозом в Канаде, Северной Америке и Северной Европе достигает 80%. Мутация delF508 легко диагностируется методом ПЦР и электрофоретического разделения ампли-фицированных фрагментов ДНК. На рис.57 представлены мутации в гене CFTR, диагностируемые в лаборатории пренатальной диагностики наследственных и врожденных заболеваний ИАГ им. Д. О. Отта РАМН, возглавляемой чл-корр. РАМН проф. В. С. Барановым, указано количество обследованных семей больных муковисцидозом и дан пример пренатальной диагностики delF508. Рисунок 57. Диагностика мутаций в гене CFTR у больных муковис-цидозом (данные 2002 г.).
В настоящее время у больных муковисцидозом идентифицировано более 1000 разных мутаций в гене CFTR, главным образом, миссенс-типа. Однако самой распространенной остается delF508. Ее частота у больных муковисцидозом в разных популяциях варьирует от 30% до 80%. В Европе наблюдается определенный градиент распространения этой мутации с севера на юг: в Дании ее частота достигает 85%, в Италии снижается до 50% и в Турции - до 20-30%. В славянских популяциях частота delF508 среди больных муковисцидозом составляет около 50%. К мажорным мутациям относятся миссенс-мутации W1272X (встречается более чем в 30% случаев у больных муковисцидозом, принадлежащих этнической группе евреев ашкенази), G542X, G551D, R117H, R334W и др. Таким образом, в 70-80% случаев молекулярная диагностика мутаций в гене CFTR оказывается успешной. Это позволяет уже в первом триместре беременности проводить пренатальную диагностику муковисцидоза с целью предупреждения повторного рождения больного ребенка в семье высокого риска.
В тех случаях, когда не удается провести молекулярную идентификацию мутаций в гене CFTR у больного или у его гетерозиготных родителей, пренатальная диагностика муковисцидоза может проводиться при сроке беременности 17-18 недель по анализу активности в амниотической жидкости ряда ферментов кишечного происхождения -гамма-глютамилтранспептидазы, аминопептидазы и кишечной формы щелочной фосфатазы. Присутствие на этом сроке слизистых пробок в кишечнике плода больного муковисцидозом приводит к снижению содержания этих ферментов в амниотической жидкости беременной женщины.
В настоящее время проводятся интенсивные исследования, направленные на выявление связей между типами мутаций в гене CFTR и клиническим полиморфизмом заболевания. Выявлены мутации, ассоциированные с тяжелыми и мягкими формами заболевания. Было установлено, что некоторые мутации, в том числе delF508, нарушают процессинг белка, в результате чего он не достигает апикальной мембраны и хлорный канал не формируется. Этим объясняется тяжелая клиника муковисцидоза при подобных нарушениях. Другие мутации (R117H, R334W, R347P), выявленные при более мягких формах муковисцидоза, не затрагивают процессинг белка, хлорный канал формируется, но работает менее интенсивно. Так, например миссенс-мутация Rl 17Н обнаружена у мужчин, страдающих бесплодием в силу закупорки семявыводящих канальцев. При этом клиника муковисцидоза у таких пациентов, как правило, отсутствует или очень стерта. То есть, у носителей мутации R117H вязкость аномального секрета, выделяемого экзокринными железами эпителия, повышена настолько незначительно, что это не приводит к аномальным процессам в легких, поджелудочной железе или в кишечнике, но это повышение достаточно для формирования непроходимости семявыводящих канальцев (vas deferens).
С использованием техники трансгеноза в различных лабораториях США и Великобритании были сконструированы модельные линии мышей с мутациями в гене муковисцидоза, в том числе и такими, которые были идентифицированы у больных. Показано, что различные мутации по-разному влияют на фенотип животных. У мышей некоторых трансгенных линий отмечено преимущественное поражение легких, тогда как в других линиях - поджелудочной железы и кишечника. В одной линии наблюдали гибель большого числа зародышей от причин, сходных с ме-кониальным илеусом. Таким образом, эти линии представляют собой идеальные модели не только для изучения молекулярных основ патогенеза муковисцидоза, но и испытания различных программ терапии этого тяжелого заболевания.
В настоящее время разработаны эффективные методы этиопато-генетического лечения, позволяющие значительно увеличить продолжительность жизни больных муковисцидозом. Лечение больных муко-висцидозом показано проводить в специализированных региональных центрах. Общая схема лечения включает применение муколитических средств, антимикробных препаратов, ферментов поджелудочной железы, витаминов, в сочетании с применением кинезо- и физиотерапии. Ведение больных муковисцидозом проводится согласно национальным рекомендациям.
