Е.Н. Андреева, Н.О. Одегова.
Для врачей: Медицинский журнал "SonoAce-Ultrasound" N22, 2011 г.
Раздел: УЗИ в акушерстве.
Возможности эхокардиографии плода в I триместре беременности (11-14 недель).
Е.Н. Андреева, Н.О. Одегова.
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
В многочисленных исследованиях зарубежных и отечественных коллег неоднократно формулировались и изучались различные группы риска по возникновению ВПС. Это делалось для того, чтобы потенциально сузить группу беременных женщин, которым показана эхокардиография в специализированном центре. Среди этих групп риска выделяли:
Семьи, имеющие ребенка с ВПС.
Семьи с ВПС у одного или обоих супругов.
Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности [5-8]. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца(рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр. Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
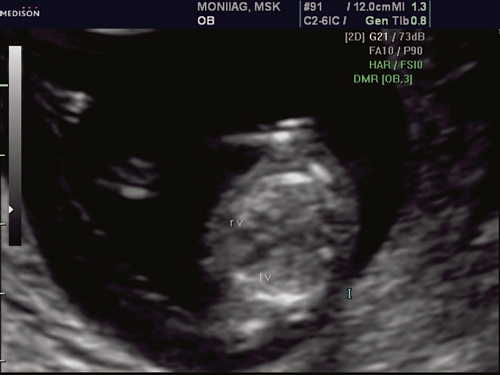
Рис. 2. Беременность 12 недель. Срез через три сосуда. Визуализируются аорта, легочной ствол. Сосуды расположены в одну линию и имеют нормальные размеры.
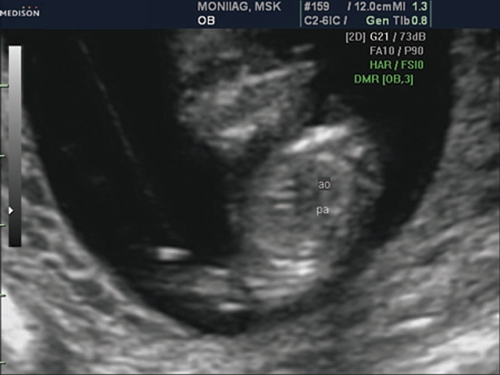
Рис. 3. Беременность 8 недель. Эктопия сердца. Сердце расположено снаружи грудной полости. Случай опубликован на сайте www.thefetus.net.
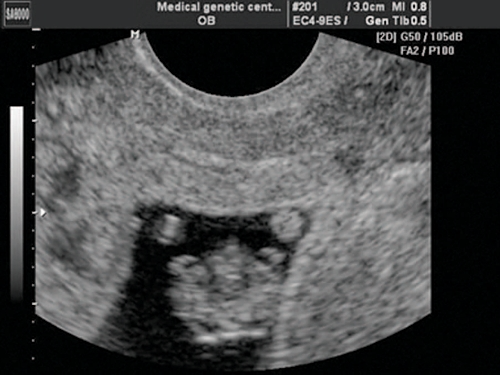
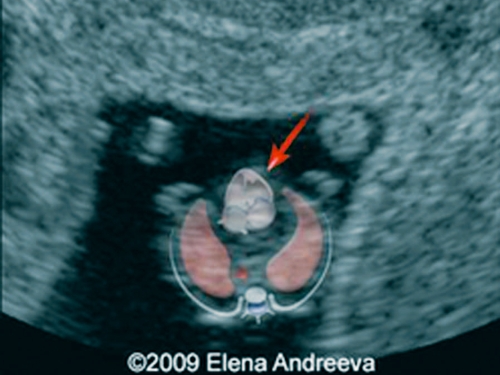
Рис. 4. Беременность 13 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца. Положение атриовентрикулярных клапанов.
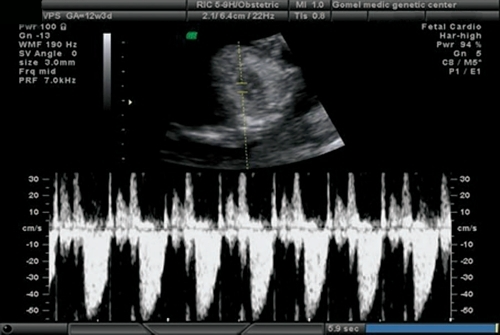
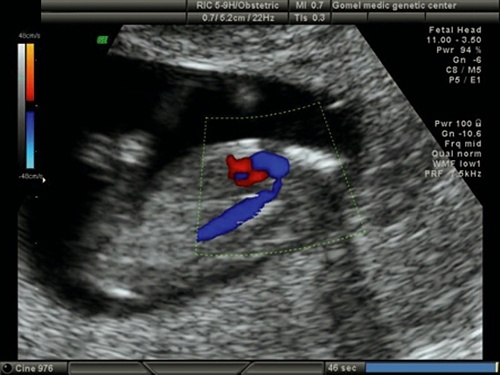
Расширенная эхокардиография предполагает применение дополнительных режимов и срезов - среза через дугу аорты (рис. 5), среза через выносящий тракт левого желудочка (рис. 6), режима ЦДК (рис. 7), импульсной допплерометрии, технологии STIC (рис. 8-11). Это обследование проводится при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА [расширение толщины воротникового пространства - ТВП, гипоплазия/отсутствие носовой кости (рис. 12, 13), регургитации в венозном протоке (рис. 14), трикуспидальной регургитации (рис. 15)] и/или врожденных пороков развития плода.
Рис. 5. Беременность 13 недель. Срез через дугу аорты. Отчетливо видны три плечеголовных сосуда, отходящих от дуги.
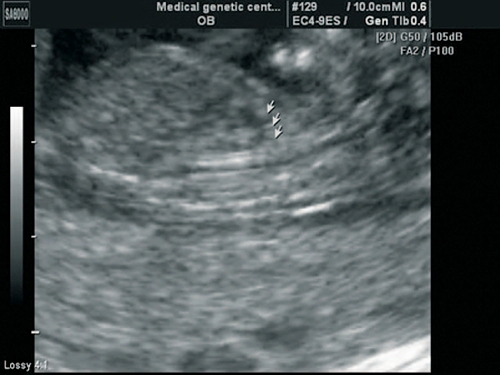
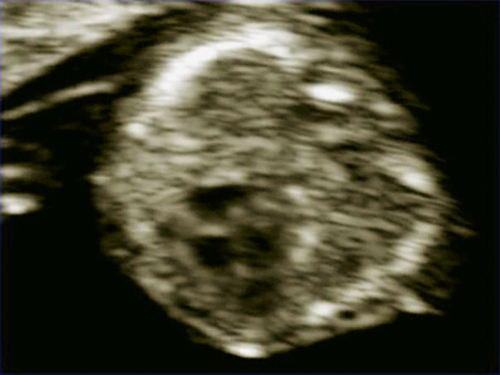
Рис. 6. Беременность 12 недель. Тетрада Фалло. Режим ЦДК. Срез через выносящий тракт левого желудочка. Видна аорта-"наездница", сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.
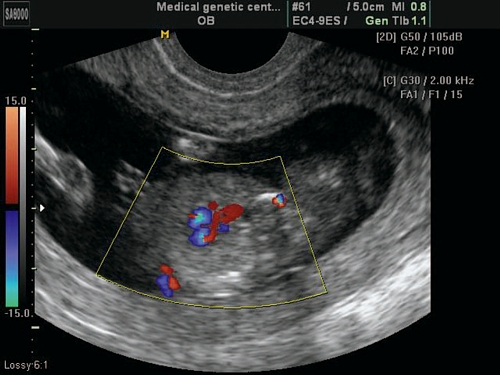
Рис. 7. Беременность 13 недель. Двойной выход сосудов из правого желудочка. Режим ЦДК. Параллельный выход сосудов из правого желудочка.
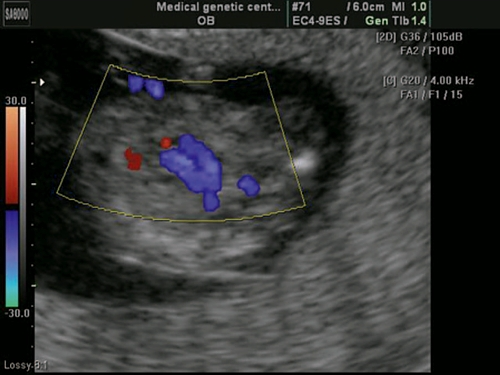
Рис. 8. Беременность 12 недель. Атриовентрикулярная коммуникация (АВК) при синдроме Дауна. Режим STIC.
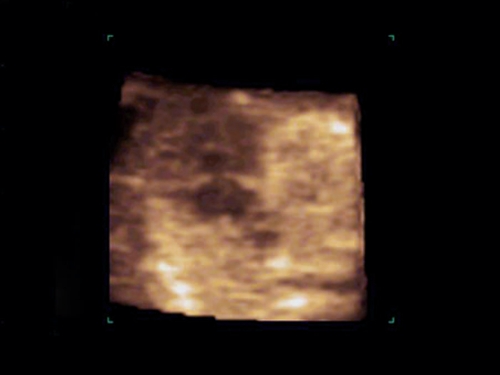
Рис. 9. Беременность 12 недель. Тетрада Фалло. Режим STIC. Аорта-"наездница", сидящая над ДМЖП. Случай опубликован на сайте www.thefetus.net.
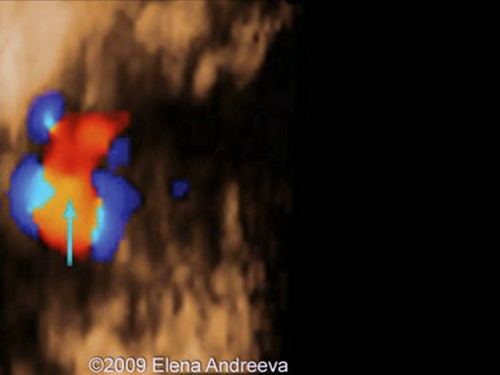
Рис. 10. Беременность 13 недель. Транспозиция магистральных сосудов. Режим STIC. Виден параллельный ход выносящих сосудов, верхний из которых выходит из левого желудочка и делится на бифуркацию (легочная артерия).
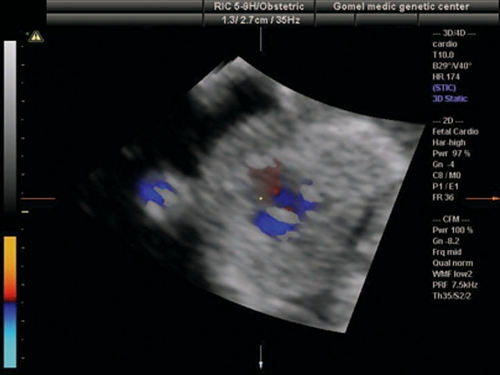
Рис. 11. Беременность 12 недель. Общий артериальный ствол. Режим STIC. Виден единый выносящий сосуд из двух желудочков.
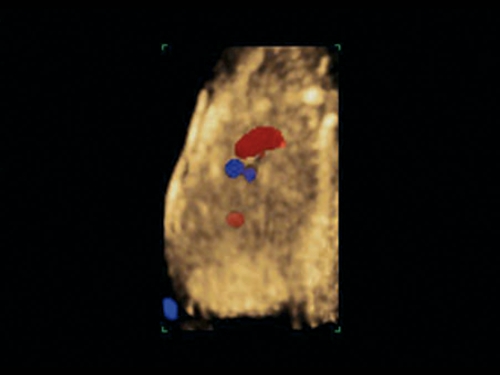
Рис. 12. Беременность 11,4 недель. Множественные маркеры ХА. Синдром Патау (трисомия 13). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости, протуберансом на верхней челюсти (признак расщелины лица), полидактилия. У плода выявлена гипоплазия левых отделов сердца.
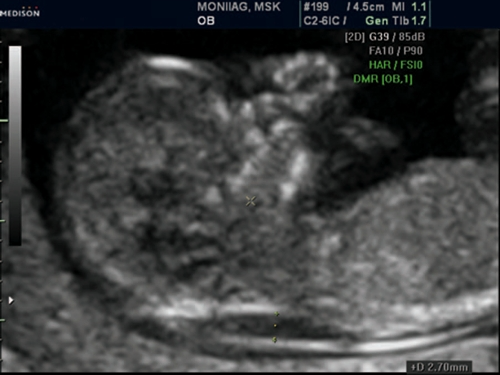
Рис. 13. Беременность 12 недель. Множественные маркеры ХА. Синдром Дауна (трисомия 21). Увеличение ТВП, аномальный профиль с гипоплазией носовой кости. У плода выявлена АВК.
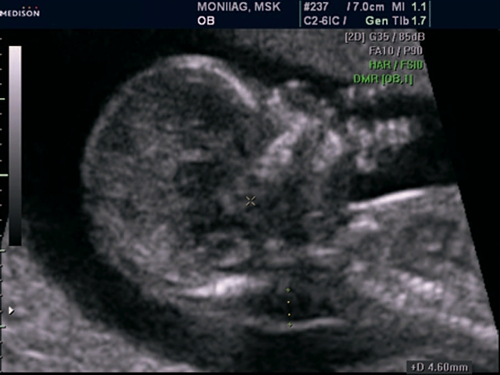
Рис. 14. Беременность 12 недель. Реверсный кровоток в венозном протоке у плода с гетеротаксией.
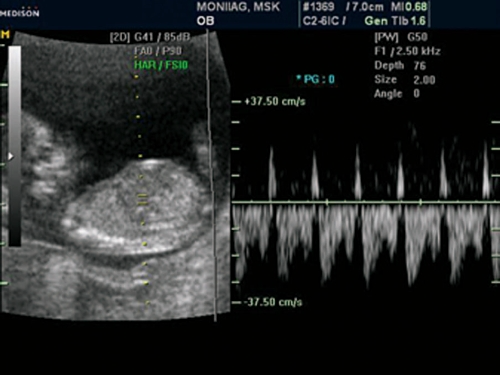
Рис. 15. Беременность 12 недель. Трикуспидальная регургитация у плода с общим артериальным стволом.
Нозология выявленных нами ВПС была следующей:
синдром гипоплазии левых отделов сердца (СГЛОС) - 29 случаев (рис. 16);
атриовентрикулярная коммуникация (АВК) - 23 (рис. 17, 18);
дефект межжелудочковой перегородки (ДМЖП) - 19 (рис. 19);
патология магистральных сосудов - 19 (из них транспозиция - 3, двойное отхождение сосудов из правого желудочка - 2, тетрада Фалло - 5, общий артериальный ствол - 9);
патология правых отделов сердца (патология трикуспидального клапана) - 3;
синдром гетеротаксии - 6;
единственный желудочек - 4;
эктопия сердца - 7;
сочетанные формы ВПС встретились в 15 случаях.
Рис. 16. Беременность 13 недель. Синдром гипоплазии левых отделов сердца у плода с синдромом Тернера (45Х). Единый поток через трикуспидальный клапан. Сброс крови в гипоплазированный левый желудочек через ДМЖП.
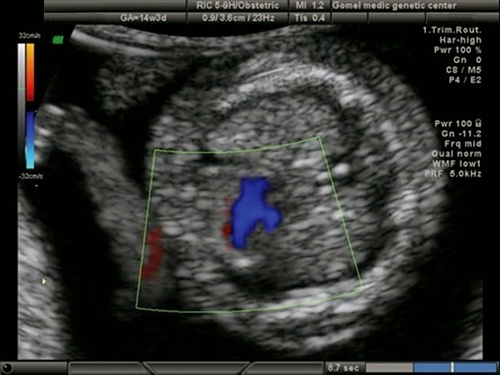
Рис. 17. Беременность 11,4 недель. Четырехкамерный срез сердца. Единый атриовентрикулярный клапан. Отсутствует "крест" нормального взаимоотношения атриовентрикулярных клапанов и сердечных перегородок.
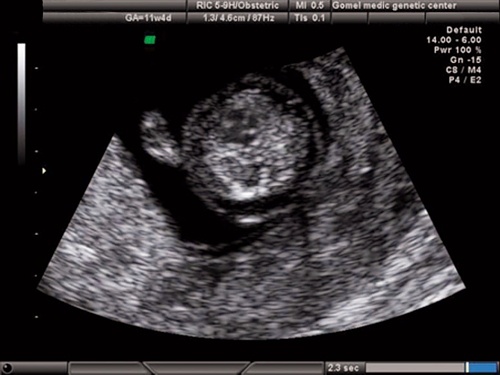
Рис. 18. Беременность 11,4 недель. Четырехкамерный срез сердца. Режим ЦДК. Единый атриовентрикулярный клапан.
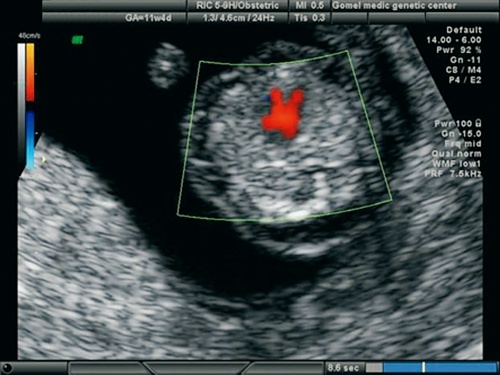
Рис. 19. Беременность 12 недель. Режим ЦДК. Обширный ДМЖП у плода с синдромом Эдвардса (трисомия 18).
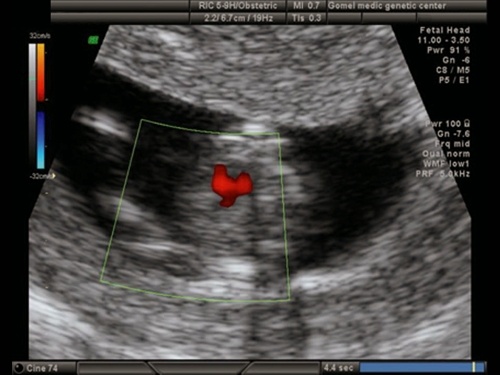
При кариотипировании плодов с пренатально установленным диагнозом ВПС в 11-14 недель было диагностировано 68 хромосомных аномалий:
трисомия 21 (синдром Дауна) выявлена в 23 (34%) случаях,
трисомия 18 (синдром Эдвардса) - в 19 (28%);
трисомия 13 (синдром Патау) - в 7 (10%);
моносомия Х (синдром Тернера) - в 6 (9%);
триплоидия - в 8 (12%);
другие хромосомные дисбалансы - в 5 (7%).
Особо следует отметить, что в 8 случаях обнаруженных ХА показанием к кариотипированию было выявление ВПС. У этих плодов было нормальное значение как ТВП, так и длины носовой кости.
При ХА выявленные ВПС по нозологии имели следующие особенности: у большинства плодов с синдромом Дауна диагностировались АВК и ДМЖП; с синдромом Патау - СГЛОС и ДМЖП; с синдромом Эдвардса - ДМЖП, тетрада Фалло и ОАС; при синдроме Тернера - СГЛОС и патология аорты - коарктация аорты в типичном месте (рис. 20).
Рис. 20. Беременность 12 недель. Срез через дугу аорты. Режим ЦДК. Сужение аорты в "типичном" месте у плода с синдромом Тернера (45Х).
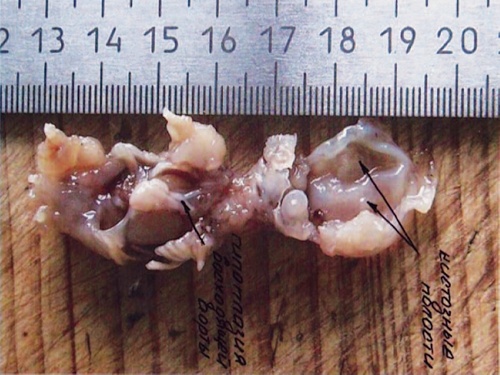
Необходимо отдельно рассмотреть вопрос верификации ультразвукового диагноза. Все беременности с изолированными ВПС в I триместре пролонгировались до срока II триместра, когда возможна 100% морфологическая верификация диагноза. В современных условиях верификация диагнозов после прерывания беременности в I триместре представляет довольно значимую проблему. Однако при специализированном обучении специалистов-морфологов верификация ВПС возможна и при прерывании беременности в I триместре (рис. 21, 22). Это, несомненно, зависит от качества полученного материала, квалификации морфолога и специального оборудования, необходимого в некоторых случаях, а также от общих методологических подходов к анатомо-морфологической диагностике независимо от срока гестации.
Рис. 21. Беременность 13 недель. Увеличенная ТВП у плода с гипоплазией левых отделов сердца.
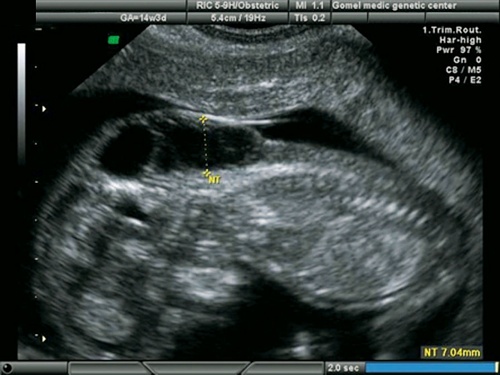
Рис. 22. Тот же плод. Морфологическое обследование.
Заключение
Из сказанного выше можно сделать следующие выводы.
Сердце плода необходимо оценивать у всех беременных при скрининговом осмотре в I триместре (11-14 нед). Так как современная концепция развития пренатальной диагностики в рамках "пилотного" проекта МЗ РФ подразумевает скрининговое обследование в I триместре врачом-экспертом, именно он и должен оценить сердце плода и заподозрить ВПС уже в конце I триместра беременности.
Для исключения летальной и клинически значимой сердечной патологии в I триместре обязательна оценка четырехкамерной проекции сердца плода и среза через три сосуда.
Расширенная эхокардиография должна проводиться при обнаружении аномальных скрининговых проекций сердца плода, маркеров ХА и/или ВПР плода.
При выявлении ВПС в I триместре показано кариотипирование плода.
Литература
Office for National Statistics. Mortality Statistics. Childhood, Infancy and Perinatal. Series DH3. Stationary Office: London, 2007; 40.
Новикова И.В., Прибушеня О.В., Румянцева Н.В. Формирование групп риска по дородовой диагностике врожденных пороков сердца. Инструкция по применению. Минск, 2004.
Carvalho J.S., Moscoso G., Tekay A. et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart. 2004; 90: 921-926.
Becker R., Wegner R.-D. Detailed screening for fetal anomalies and cardiac defects at the 11-13 week scan. Ultrasound Obstet Gynecol 2006; 27; 613-618.
Allan L.D., Sharland G.K., Milburn A. et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol 1994; 23: 1452-1458.
Huggon I.C., Ghi T., Cook A.C. et al. Fetal cardiac abnor-malities identified prior to 14 weeks' gestation. Ultrasound. Obstet. Gynecol. 2011; 20: 22-29.
Persico N., Moratalla J., Lombardi C.M. et al. Fetal echocardiography at 11-13 weeks by transabdominal high-frequency ultrasound Ultrasound Obstet. Gynecol. 2011; 37: 296-301
Allan L.D. Echocardiographic detection of congenitalheart disease in the fetus: present and future. Br. Heart. J. 1995; 74: 103-106.
