Опыт 6. реакция раствора нитрата серебра
Определить индикатором реакцию раствора нитрата серебра. Сделать вывод о силе гидроксида серебра как основания.
ПРИЛОЖЕНИЯ
Таблица 1.
Растворимость солей (1 г на 100 г воды) при различных температурах
| Температура, ºС | NaCl | NaNO3 | Na2SO4·10H2O[1] | KNO3 | K2Cr2O7 | (NH4)2SO4 | Ca(CH3COO)2 | CuSO4·5H2O1 | CuSO4·(NH4)2SO4 |
| 32,28 | 35,5 35,7 35,9 36,0 36,1 – 36,4 36,8 37,2 37,5 38,1 – 38,7 39,4 | 72,7 79,9 87,6 91,6 96,1 – 104,9 114,1 124,7 – – – | 4,5 9,6 19,2 27,9 40,8 49,8[2] 48,4 46,6 45,3 44,1 43,3 – 42,7 42,3 | 13,1 21,2 31,6 37,9 46,0 – 63,9 85,5 110,1 137,5 168,8 – 204,9 243,6 | 4,68 7,75 12,48 15,0 18,2 – 25,9 – 45,56 – 73,01 – – 100,0 | 70,1 72,7 75,4 76,9 78,1 – 82,1 84,3 90,6 94,1 – 97,8 | 37,4 36,0 34,7 34,2 33,8 – 33,2 – 32,7 – 33,5 32,9 31,1 29,7 | 14,3 17,2 20,5 22,3 24,4 – 28,7 33,7 39,5 – 55,5 – 76,7[3] 77,0 | 11,5 15,1 19,4 22,3 24,4 – 30,5 37,6 46,3 56,8 69,7 – 86,0 107,1 |
Таблица 2.
Растворимость кислот, солей и оснований в воде
| H+ | NH4+ | K+ | Na+ | Ag+ | Ba2+ | Ca2+ | Mg2+ | Mn2+ | Zn2+ | Ni2+ | Sn2+ | Pb2+ | Cu2+ | Hg2+ | Hg22+ | Fe2+ | Fe3+ | Al3+ | Cr3+ | |
| OH– | р | р | р | – | р | м | м | н | н | н | н | н | н | – | – | н | н | н | н | |
| NO3– | р | р | р | р | р | р | р | р | р | р | р | р | р | р | р | – | р | р | р | р |
| F– | р | р | р | р | р | м | н | м | р | м | р | р | м | р | – | м | м | н | м | м |
| Cl– | р | р | р | р | н | р | р | р | р | р | р | р | м | р | р | н | р | р | р | р |
| Br– | р | р | р | р | н | р | р | р | р | р | р | р | м | р | м | н | р | р | р | р |
| I– | р | р | р | р | н | р | р | р | р | р | р | р | н | – | н | н | р | – | р | р |
| S2– | р | р | р | р | н | – | – | – | н | н | н | н | н | н | н | н | н | н | – | – |
| SO32– | р | р | р | р | м | м | м | м | н | м | н | – | н | – | – | – | м | – | – | – |
| SO42– | р | р | р | р | м | н | м | р | р | р | р | р | н | р | р | м | р | р | р | р |
| CO32– | р | р | р | р | н | н | н | н | н | н | – | – | н | – | – | н | н | – | – | – |
| SiO32– | н | – | р | р | н | н | н | н | н | н | н | – | н | – | – | – | н | – | – | – |
| PO43– | р | р | р | р | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н |
| CH3COO– | р | р | р | р | р | р | р | р | р | р | р | р | р | р | р | м | р | р | р | р |
Обозначения: р – растворимое вещество (больше 10 г на 1000 г воды); м – малорастворимое вещество (от 10 до 0,01 г на 1000 г воды); н – практически нерастворимое (меньше 0,01 г на 1000 г воды); черта означает, что вещество не существует или разлагается водой.
Таблица 3.
Растворимость в воде солей и оснований (при 18°С)
| Анионы | Катионы | ||||||||
| Na+ | K+ | Ag+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Zn2+ | Pb2+ | |
| F– Cl– Br– I– NO3– ClO3– SO42– CO32– CrO42– C2O42– OH– | 4,44 35,86 88,76 177,9 83,97 97,16 16,83 16,39 61,21 3,34 116,4 | 92,56 32,95 65,86 137,5 30,34 6,6 11,11 108,0 63,1 30,27 142,9 | 195,4 1,6·10–4 1·10–5 3,5·10–7 213,4 12,25 0,55 0,003 0,0025 0,0035 0,01 | 0,0076 55,80 103,1 148,2 74,3 126,4 35,43 0,01 73,0 0,03 0,001 | 0,0016 73,19 143,3 121,8 179,3 0,20 0,0013 0,4 5,6·10–4 0,17 | 0,012 51,09 96,52 169,2 66,27 174,9 0,011 0,0011 0,12 0,0046 0,77 | 0,16 37,24 103,6 201,4 8,74 35,42 2,3·10–4 0,0023 3,8·10–4 0,0086 3,7 | 0,005 203,9 478,2 419,0 117,8 183,9 53,12 0,004 – 0,0006 0,0005 | 0,07 1,49 0,598 0,08 51,66 150,6 0,0041 0,0001 0,00002 1,5·10–4 0,01 |
Примечание. Числа показывают, сколько граммов безводного вещества растворяется в 100 г воды.
Таблица 4.
ω (%) и плотность растворов солей (при 20°С)
| ω (%) | Плотность растворов солей, г/см3 | ω (%) | Плотность растворов солей, г/см3 | ||||
| NaCl | Na2CO3 | BaCl2 | NaCl | Na2CO3 | BaCl2 | ||
| 1,005 1,013 1,027 1,041 1,056 1,071 | 1,009 1,019 1,040 1,061 1,082 1,103 | – 1,016 1,034 1,053 1,072 1,092 | 1,086 1,101 1,116 1,132 1,148 1,164 | 1,124 1,146 | 1,113 1,134 1,156 1,179 1,203 1,228 |
В таблицах 4, 5 приведена относительная плотность 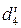 , т. е. плотность раствора при t°C, относящаяся к плотности воды при 4°C.
, т. е. плотность раствора при t°C, относящаяся к плотности воды при 4°C.
Таблица 5.
ω (%) и плотность раствора кислот и щелочей (при 15°С)
| ω (%) | Плотность раствора, г/см3 | ||||||
| H2SO4 | HNO3 | HCl | CH3COOH | KOH | NaOH | NH3 | |
| 1,027 1,055 1,083 1,112 1,143 1,174 1,205 1,238 1,273 1,307 1,342 1,380 1,419 1,460 1,503 1,547 1,594 1,640 1,687 1,732 1,776 1,808 1,830 1,840 1,838 | 1,022 1,044 1,068 1,093 1,119 1,145 1,171 1,198 1,225 1,251 1,277 1,303 1,328 1,351 1,373 1,394 1,412 1,429 1,445 1,460 1,474 1,486 1,496 1,504 1,522 | 1,019 1,039 1,059 1,079 1,100 1,121 1,142 1,163 1,183 | 1,0052 1,0113 1,0171 1,0228 1,0284 1,0337 1,0388 1,0436 1,0481 1,0523 1,0562 1,0598 1,0631 1,0660 1,0685 1,0707 1,0725 1,0740 1,0747 1,0748 1,0742 1,0726 1,0696 1,0644 1,0553 | 1,033 1,065 1,100 1,137 1,176 1,217 1,263 1,310 1,358 1,411 1,460 1,511 1,564 1,616 | 1,046 1,092 1,137 1,181 1,225 1,268 1,310 1,352 1,395 1,437 1,478 1,519 1,560 1,601 1,643 | 0,983 0,967 0,953 0,939 0,926 0,913 0,903 0,893 0,884 |
Таблица 6.
Концентрация и плотность кислот и оснований при 20°С
| ω , % | H2SO4 | HCl | HNO3 | H3PO4 | CH3COOH | NaOH | KOH | растворNH3 |
| 1,005 1,012 1,018 1,025 1,032 | 1,003 1,008 1,013 1,018 1,023 | 1,004 1,009 1,015 1,020 1,026 | 1,004 1,009 1,015 1,020 1,026 | 1,000 1,001 1,003 1,004 1,006 | 1,010 1,021 1,032 1,043 1,054 | 1,007 1,017 1,026 1,035 1,044 | 0,994 0,990 0,985 0,981 0,977 | |
| 1,039 1,045 1,052 1,059 1,066 | 1,028 1,033 1,038 1,043 1,047 | 1,031 1,037 1,043 1,049 1,054 | 1,031 1,037 1,042 1,048 1,053 | 1,007 1,008 1,010 1,011 1,013 | 1,065 1,076 1,087 1,098 1,109 | 1,053 1,062 1,072 1,081 1,090 | 0,973 0,969 0,965 0,961 0,958 | |
| 1,080 1,095 1,109 1,124 1,139 | 1,057 1,068 1,078 1,088 1,098 | 1,066 1,078 1,090 1,103 1,115 | 1,065 1,076 1,088 1,101 1,113 | 1,015 1,018 1,021 1,024 1,026 | 1,131 1,153 1,175 1,197 1,219 | 1,109 1,128 1,148 1,167 1,186 | 0,950 0,943 0,936 0,930 0,923 | |
| 1,155 1,170 1,186 1,202 1,219 | 1,108 1,119 1,129 1,139 1,149 | 1,128 1,140 1,153 1,167 1,180 | 1,126 1,140 1,153 1,167 1,181 | 1,029 1,031 1,034 1,036 1,038 | 1,241 1,263 1,285 1,306 1,328 | 1,206 1,226 1,247 1,267 1,288 | 0,916 0,910 0,904 0,898 0,892 | |
| 1,260 1,303 1,348 | 1,174 1,198 | 1,214 1,246 1,278 | 1,216 1,254 1,293 | 1,044 1,049 1,053 | 1,380 1,430 1,478 | 1,341 1,396 1,452 | ||
| 1,395 1,445 1,498 | 1,310 1,339 1,367 | 1,335 1,379 1,426 | 1,058 1,061 1,064 | 1,525 | 1,511 | |||
| 1,553 1,611 1,669 | 1,391 1,413 1,434 | 1,476 1,526 1,579 | 1,067 1,069 1,070 | |||||
| 1,727 1,779 1,814 | 1,452 1,469 1,483 | 1,633 1,689 1,746 | 1,070 1,069 1,066 | |||||
| 1,824 1,831 1,836 | 1,487 1,491 1,495 | 1,770 1,794 1,819 | 1,064 1,062 1,059 | |||||
| 1,836 1,831 | 1,501 1,513 | 1,844 1,870 | 1,055 1,050 |
Таблица 7.
Произведение растворимости труднорастворимых веществ
(при комнатной температуре)
| Вещество | ПР | Вещество | ПР |
| AgBr | 5,3·10–13 | FeS | 5·10–18 |
| AgCN | 1,4·10–16 | HgS | 1,6·10–52 |
| AgSCN | 1·10–12 | Hg2Cl2 | 1,3·10–18 |
| AgCl | 1,78·10–10 | Mg(OH)2 | 7,1·10–12 |
| Ag2CO3 | 1,2·10–12 | MgS | 2,0·10–15 |
| Ag2CrO4 | 1,1·10–12 | Mn(OH)2 | 1,9·10–13 |
| Ag2Cr2O7 | 1·10–10 | MnS | 2,5·10–10 |
| AgI | 8,3·10–17 | NiCO3 | 1,3·10–7 |
| Ag3PO4 | 1,3·10–20 | Ni(OH)2 | 2·10–15 |
| Al(OH)3 | 3,2·10–34 | PbCO3 | 7,5·10–14 |
| BaCO3 | 4,0·10–10 | PbCl2 | 1,6·10–5 |
| BaC2O4 | 1,1·10–7 | PbCrO4 | 1,8·10–14 |
| BaCrO4 | 1,2·10–10 | PbI2 | 1,1·10–9 |
| BaSO4 | 1,1·10–10 | Pb(OH)2 | 7,9·10–16 |
| CaCO3 | 3,8·10–9 | PbS | 2,5·10–27 |
| CaC2O4 | 2,3·10–9 | PbSO4 | 1,6·10–8 |
| CaSO4 | 2,5·10–5 | Sb2S3 | 1,0·10–30 |
| CdS | 1,6·10–28 | H2SiO3 | 1,0·10–10 |
| Cr(OH)3 | 6,3·10–31 | SnS | 2,5·10–27 |
| Cu(OH)2 | 8,3·10–20 | SrCO3 | 1,1·10–10 |
| CuS | 6,3·10–36 | SrC2O4 | 1,6·10–7 |
| FeCO3 | 3,5·10–11 | SrSO4 | 3,2·10–7 |
| Fe(OH)2 | 7,1·10–16 | Zn(OH)2 | 1,4·10–17 |
| Fe(OH)3 | 6,3·10–38 | ZnS | 8·10–26 |
Таблица 8.
Константы нестойкости комплексных ионов
| Формула комплекса | Выражение для константы нестойкости | Числовое значение константы нестойкости |
| [Ag(NH3)2]+ | 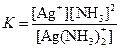 | 6,8·10–8 |
| [Ag(S2O3)2]3– | 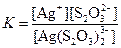 | 1,0·10–13 |
| [Ag(CN)2]– |  | 1·10–21 |
| [Cu(NH3)4]2+ | 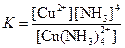 | 2,1·10–13 |
| [CuCN)4]2– | 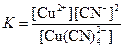 | 5·10–28 |
| [Cd(CN)4]2– | 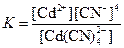 | 1,4·10–17 |
| [Cd(NH3)4]2+ | 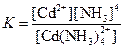 | 1·10–7 |
| [HgI4]2– | 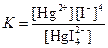 | 5·10–31 |
| [Hg(SCN)4]2– | 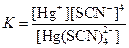 | 1·10–22 |
| [Zn(NH3)4]2+ | 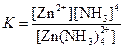 | 3,5·10–10 |
| [NH4]+ | 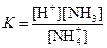 | 6,0·10–10 |
| [Al(OH)4]– |  | 1·10–33 |
| [Cr(OH)4]– | 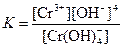 | 1,2·10–30 |
| [Zn(OH)4]2– | 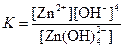 | 2,2·10–15 |
Таблица 9.
Стандартные электродные потенциалы некоторых окислительно-восстановительных систем:
(г) – газ; (ж) – жидкость; (тв) – твёрдое вещество
| Окисленная форма | Восстановленная форма | Уравнение реакции | Е°, В |
| Li+ | Li (тв) | Li+ + e– ↔ Li | –3,02 |
| K+ | K (тв) | K+ + e– ↔ K | –2,92 |
| Ba2+ | Ba (тв) | Ba2+ + 2e– ↔ Ba | –2,90 |
| Sr2+ | Sr (тв) | Sr2+ + 2e– ↔ Sr | –2,89 |
| Ca2+ | Ca (тв) | Ca2+ + 2e– ↔ Ca | –2,87 |
| Na+ | Na (тв) | Na+ + e– ↔ Na | –2,71 |
| Mg2+ | Mg (тв) | Mg2+ + 2e– ↔ Mg | –2,34 |
| Al3+ | Al (тв) | Al3+ + 3e– ↔ Al | –1,67 |
| Mn2+ | Mn (тв) | Mn2+ + 2e– ↔ Mn | –1,05 |
| SO42– | SO32– | SO42– + 2e– + H2O ↔ SO32– + 2OH– | –0,90 |
| NO3– | NO2 (г) | NO3– + e– + H2O ↔ NO2 + 2OH– | –0,85 |
| Zn2+ | Zn (тв) | Zn2+ + 2e– ↔ Zn | –0,76 |
| Cr3+ | Cr (тв) | Cr3+ + 3e– ↔ Cr | –0,71 |
| AsO43– | AsO2– | AsO43– + 2e– + 2H2O ↔ AsO2– + 4OH– | –0,71 |
| Fe(OH)3 | [Fe(OH)2] (тв) | Fe(OH)3 + e– ↔ [Fe(OH)2] + OH– | –0,56 |
| Fe2+ | Fe (тв) | Fe2+ + 2e– ↔ Fe | –0,44 |
| Cd2+ | Cd (тв) | Cd2+ + 2e– ↔ Cd | –0,40 |
| Co2+ | Co (тв) | Co2+ + 2e– ↔ Co | –0,28 |
| Ni2+ | Ni (тв) | Ni2+ + 2e– ↔ Ni | –0,25 |
| NO3– | NO (г) | NO3– + 3e– + 2H2O ↔ NO + 4OH– | –0,14 |
| Sn2+ | Sn (тв) | Sn2+ + 2e– ↔ Sn | –0,14 |
| Pb2+ | Pb (тв) | Pb2+ + 2e– ↔ Pb | –0,13 |
| CrO42– | Cr(OH)3 | CrO42– + 2e– + 4H2O ↔ Cr(OH)3 + 5OH– | –0,12 |
| 2H+ | H2 | 2H+ + 2e– ↔ H2 | ±0,00 |
| NO3– | NO2– | NO3– + 2e– + H2O ↔ NO2– + 2OH– | +0,01 |
| S (тв) | H2S | S + 2e– + 2H+ ↔ H2S | +0,14 |
| Sn4+ | Sn2+ | Sn4+ + 2e– ↔ Sn2+ | +0,15 |
| Co(OH)3 | Co(OH)2 | Co(OH)3 + e– ↔ Co(OH)2 + OH– | +0,20 |
| SO42– | H2SO3 | SO42– + 2e– + 4H+ ↔ H2SO3 + H2O | +0,20 |
| Cu2+ | Cu (тв) | Cu2+ + 2e– ↔ Cu | +0,34 |
| Co3+ | Co (тв) | Co3+ + 3e– ↔ Co | +0,43 |
| H2SO3 | S (тв) | H2SO3 + 4e– + 4H+ ↔ S + 3H2O | +0,45 |
| Ni(OH)3 | Ni(OH)2 | Ni(OH)3 + e– ↔ Ni(OH)2 + OH– | +0,49 |
| ClO4– | Cl– | ClO4– + 8e– + 4H2O ↔ Cl– + 8OH– | +0,51 |
| I2 | 2I– | I2 + 2e– ↔ 2I– | +0,53 |
| MnO4– | MnO42– | MnO4– + e– ↔ MnO42– | +0,54 |
| MnO4– | MnO2 (тв) | MnO4– + 3e– + 2H2O ↔ MnO2 + 4OH– | +0,57 |
| MnO42– | MnO2 (тв) | MnO42– + 2e– + 2H2O ↔ MnO2 + 4OH– | +0,58 |
| BrO3– | Br– | BrO3– + 6e– + 3H2O ↔ Br– + 6OH– | +0,60 |
| O2 | H2O2 | O2 + 2e– + 2H+ ↔ H2O2 | +0,68 |
| H2SeO3 | Se | H2SeO3 + 4e– + 4H+ ↔ Se + 3H2O | +0,74 |
| Fe3+ | Fe2+ | Fe3+ + e– ↔ Fe2+ | +0,77 |
| NO3– | NO2 (г) | NO3– + e– + 2H+ ↔ NO2 + H2O | +0,81 |
| Продолжение | |||
| Окисленная форма | Восстановленная форма | Уравнение реакции | Е°, В |
| NO3– | NH4+ | NO3– + 8e– + 10H+ ↔ NH4+ + 3H2O | +0,87 |
| NO3– | NO (г) | NO3– + 3e– + 4H+ ↔ NO + 2H2O | +0,96 |
| HNO2 | NO (г) | HNO2 + e– + H+ ↔ NO + H2O | +0,99 |
| Br2 (ж) | 2Br– | Br2 + 2e– ↔ 2Br– | +1,08 |
| IO3– | I– | IO3– + 6e– + 6H+ ↔ I– + 3H2O | +1,09 |
| MnO2 (тв) | Mn2+ | MnO2 + 2e– + 4H+ ↔ Mn2+ + 2H2O | +1,28 |
| ClO4– | Cl– | ClO4– + 8e– + 8H+ ↔ Cl– + 4H2O | +1,34 |
| Cl2 (г) | 2Cl– | Cl2 + 2e– ↔ 2Cl– | +1,36 |
| Cr2O72 | 2Cr3+ | Cr2O72 + 6e– + 14H+ ↔ 2Cr3+ + 7H2O | +1,36 |
| ClO3– | Cl– | ClO3– + 6e– + 6H+ ↔ Cl– + 3H2O | +1,45 |
| PbO2 (тв) | Pb2+ | PbO2 + 2e– + 4H+ ↔ Pb2+ + 2H2O | +1,46 |
| HClO | Cl– | HClO + 2e– + H+ ↔ Cl– + H2O | +1,50 |
| MnO4– | Mn2+ | MnO4– + 5e– + 8H+ ↔ Mn2+ + 4H2O | +1,52 |
| H2O2 | H2O | H2O2 + 2e– + 2H+ ↔ 2H2O | +1,77 |
| Co3+ | Co2+ | Co3+ + e– ↔ Co2+ | +1,84 |
| F2 (г) | 2F– | F2 + 2e– ↔ 2F– | +2,85 |
Таблица 10.
