Методические указания к лабораторным занятиям
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Воронежский государственный педагогический университет
Кафедра химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНЫМ ЗАНЯТИЯМ
УЧЕБНОГО КУРСА
«Химия d- элементов»
направление подготовки 050100.01.62
педагогическое образование
профили «Химия», «Экология»
Воронеж 2012 г
Химия d-элементов является основой для изучения последующих дисциплин естественнонаучного цикла, таких как физика, экология, концепция современного естествознания и т.д.
Учебно-методическое руководство к лабораторным занятиям по химии d-элементов предназначено для студентов отделения “Химия – экология” естественно-географического факультета ВГПУ. Предлагаемое руководство содержит материал по всем изучаемым разделам химии d-элементов. Методические указания содержат планы лабораторных занятий по химии d-элементов и краткие описания лабораторных работ. Приведен список рекомендуемой литературы.
Цель лабораторных занятий – углубить и закрепить представления о физических и химических свойствах неорганических веществ, образованных d-элементами, а так же способы получения и применение их соединений. Привить навыки самостоятельного выполнения эксперимента и обобщения полученных данных. Настоящие методические указания призваны помочь в достижении данной цели.
Авторы выражают особую признательность Григоренко Людмиле Константиновне за предоставленную возможность частично использовать аналитический материал, собранный ею за время долголетней педагогической деятельности на кафедре химии естественно-географического факультета ВГПУ.
Компетенции обучающегося, формируемые в результате освоения дисциплины:
Изучение дисциплины “Химия d-элементов” направлено на формирование у обучающихся следующих компетенций.
1. Владеет основными физическими и химическими понятиями, знаниями фундаментальных законов физики и химии, явлений и процессов, изучаемых этими науками:
- знает сущность стехиометрических и газовых законов, понятия и основные положения термодинамики, фазовые равновесия, равновесия в растворах электролитов, понятия и основные закономерности химической кинетики, катализа и электрохимии;
- знает вербальные формулировки и аналитические выражения основных законов, изучаемых в общей химии;
- знает основные методы эмпирических исследований в естественных науках;
- иллюстрирует закономерности примерами, в том числе из человеческой практики;
- умеет использовать справочную химическую и физическую литературу для нахождения и расчёта характеристик изучаемых систем;
- находит необходимые справочные данные, рассчитывает энергетику химических реакций;
- находит и учитывает с целью прогноза направления реакций потенциалы различных химических и электрохимических процессов (потенциалы Гиббса, электродные) в стандартных условиях;
- решает типовые, нестандартные качественные и расчётные задачи;
- владеет современным химическим языком, терминологией и символами;
- использует современную систему наименований веществ, термины и символы, используемые в общей и неорганической химии.
2. Способен выбрать методику экспериментальной работы, обосновать и изложить основы метода, составить план проведения работы, выбрать реактивы, посуду, детали прибора, собрать установку, провести необходимые расчеты:
- знает общие правила проведения эксперимента, общие положения по организации охраны труда и техники безопасности при выполнении конкретных работ, опытов и отдельных операций в химической лаборатории;
- соблюдает правила техники безопасности при работе в химической лаборатории;
- выполняет рекомендации по подготовке рабочего места, оборудования, приборов, реактивов;
- владеет навыками обращения с наиболее широко применяемыми в учебной и исследовательской практике реактивами, материалами, посудой и оборудованием;
- работает с обычной и мерной посудой (колбами, цилиндрами, мензурками, пипетками);
- проводит химический эксперимент на оборудовании, с приборами и посудой рекомендованными для макро- и полумикрометодов работы;
- умеет проводить описанные в практикумах опыты, представлять результаты в табличной, графической формах и диаграммах, давать качественную оценку полученным результатам;
- использует компьютерную графику;
- знает типы и источники экспериментальных ошибок;
- понимает простейшие методики статистической обработки экспериментальных данных.
Общие указания к выполнению
Лабораторного практикума
При подготовке к очередной лабораторной работе студент должен дома по учебнику изучить теоретический материал. После этого письменно выполнить по руководству упражнения и ознакомиться с введением к работе и описанием опытов. Придя в лабораторию, студент показывает преподавателю оформленный журнал с описанием предыдущей работы и выполненные им упражнения; только после этого, с разрешения преподавателя, приступает к очередной работе.
Прежде чем выполнять опыт, необходимо внимательно прочитать описание его, составить себе ясное представление о цели данного опыта, об условиях и порядке его проведения, подобрать нужную посуду и приборы. В процессе выполнения опытов надо соблюдать все меры предосторожности, с которыми надо предварительно ознакомиться.
Категорически запрещаются какие-либо отступления от условий выполнения опытов, описанных в руководстве!
В процессе работы нужно внимательно наблюдать за ходом опыта и описать все особенности его: выпадение или растворение осадков, изменение цвета, тепловые эффекты, показания приборов и т. д. Результаты опыта тотчас же по окончании его надлежит записать в лабораторный журнал, придерживаясь следующей последовательности:
1. Название лабораторной работы, ее номер, дата выполнения.
2. Наименование опыта.
3. Краткое описание хода опыта и наблюдений с обязательными ответами на вопросы, имеющиеся в тексте.
4. Уравнения реакций.
5. Числовые данные с вычислениями.
6. Рисунок прибора, выполненный в карандаше.
7. Выводы – с новой строчки и подчеркнутые (лучше цветным карандашом).
За 15 мин до окончания занятия студент предъявляет свой журнал преподавателю и приводит в порядок рабочее место.
По каждой выполненной работе студент сдает зачет. При этом студент должен хорошо разбираться во всех теоретических вопросах, относящихся к выполненной работе, ясно излагать условия опыта, описать наблюдавшиеся явления, уметь составлять молекулярные и ионные уравнения протекающих реакций.
Студент, выполнивший все работы и отчитавшийся по ним, получает общий зачет и допускается к экзамену.
КОМПЛЕКСНЫХ СОЕДИНЕНИЙ.
Лабораторная работа №1
Цель: 1) выяснить способность соединений d-элементов к комплексообразованию;
2) изучить реакции образования и разрушения комплексных соединений.
Опыт 2. анионные комплексы
а) Тетраиодовисмутат калия
В пробирку к 3 – 4 каплям раствора нитрата висмута Bi(NO3)3 прибавлять по каплям раствор иодида калияKI(Сэкв = 0,50 моль(экв)/л) до выпадения темно-бурого осадка иодида висмутаBiI3. Растворить этот осадок в избытке раствора иодида калия.
Каков цвет полученного раствора? Может ли эта окраска обуславливаться присутствием ионов K+, I–, Bi3+? Какой из этих ионов может быть комплексообразователем? С какими лигандами он мог образовать в данном растворе сложный ион? Ответ мотивировать.
Зная, что состав полученного соединения выражается эмпирической формулой KI · BiI3, написать его координационную формулу, учитывая, что координационное число Bi3+ равно четырем. Написать уравнения реакций: образования иодида висмута, взаимодействия иодида висмута с избытком иодида калия. Написать уравнение электролитической диссоциации полученного комплексного соединения.
б) Гидроксокомплексы
В три пробирки поместить раздельно растворы солей цинка, хрома (III) и алюминия и в каждую из них добавлять по каплям раствор щелочи. Наблюдать вначале выпадение осадков, а затем их растворение в избытке щелочи.
Написать уравнения проделанных реакций, учитывая, что образуются растворимые гидроксокомплексы, содержащие ионы [Zn(OH)4]2–, [Cr(OH)4]– и [Al(OH)4]–. Зная, что гидроксиды цинка, хрома и алюминия растворяются также в кислотах, указать, к какому типу они относятся.
Опыт 3. катионные комплексы
Получить осадок гидроксида никеля (II) внеся в пробирку 3 – 4 капли раствора сульфата никеля и такой же объем раствора едкого натра. Пипеткой удалить жидкую фазу.
К осадку добавить 5 – 6 капель 25%-ного раствора аммиака. Что происходит? Сравнить окраску ионов Ni2+ в растворе сульфата никеля с окраской полученного раствора.
Присутствием каких ионов обусловлена окраска раствора?
Написать уравнения реакций: образования гидроксида никеля (II), взаимодействия гидроксида никеля с аммиаком и уравнение электролитической диссоциации образовавшегося комплексного основания (координационное число никеля принять равным шести). Какое основание является более сильным: простое или комплексное? Ответ обосновать.
ОПЫТ 4. РАЗЛИЧИЕ МЕЖДУ ПРОСТЫМИ И КОМПЛЕКСНЫМИ ИОНАМИ ЖЕЛЕЗА (III)
а) К 1 – 2 мл раствора FeCl3 прилить немного раствора KSCN. Написать уравнение реакции. Эта реакция характерна для иона Fe3+ и применяется для его обнаружения.
б) Доказать, обнаруживается ли ион Fe3+в растворе K3[Fe(CN)6], проделав характерную реакцию, как предыдущем опыте.
в) Налить в одну пробирку немного раствораFeCl3 , а в другую – K3[Fe(CN)6] и добавить в каждую из них одинаковый объем раствора FeSO4. Объяснить отсутствие изменений в первой пробирке и образование во второй осадка так называемой турнбулевой сини KFe[Fe(CN)6]. Написать уравнение реакции в молекулярной и ионной форме.
Разрушение комплексов
а) Разрушение комплекса при разбавлении раствора
Внести в пробирку 2 капли раствора нитрата серебраAgNO3 и добавлять раствор иодида калияKCl(Сэкв = 0,10 моль(экв)/л) по каплям, встряхивая пробирку после каждого добавления.
Почему растворяется выпавший вначале осадок иодида серебра? К получившемуся раствору добавить 4 – 5 капель воды. Что наблюдается?
Описать наблюдаемые процессы. Написать уравнения реакций: образования иодида серебра, его перехода в комплексное соединение, диссоциации комплексного иона, выражение константы нестойкости. Какое влияние оказывает добавление раствора на диссоциацию комплексного иона?
б) Получение аммиакатов.
Налить в пробирку 1 – 2 мл раствора AgNO3 и добавить немного раствора NaCl. К образовавшемуся осадку приливать раствор аммиака до его растворения. Составить уравнения реакций, учитывая, что координационное число равно двум. Объяснить происходящие изменения.
Полученный раствор разлить в четыре пробирки и использовать в опытах б), в), д).
в) Разрушение комплекса при замене комплексообразователя.
Налить в пробирку 1 – 2 мл раствора [Ag(NH3)2]Cl, полученного в опыте 3 а), и добавить туда кусочек цинка. Что наблюдаете? Записать уравнение реакции образование комплексного аммиаката цинка, учитывая, что координационное число Zn2+ равно четырем.
Объяснить, пользуясь таблицей констант нестойкости комплексных ионов, причину вытеснения цинком серебра из его аммиачного комплексного иона.
г) Качественные реакции на ион серебра.
Налить в две пробирки одинаковые объемы раствора AgNO3. В одну из них добавить раствор NaOH, а в другую – KI. Записать наблюдения.
Эти реакции характерны для иона Ag+ и могут быть использованы для его обнаружения. Составить уравнения реакций.
Раствор [Ag(NH3)2]Cl, полученный в опыте 3 а), налить по 1 мл в две пробирки. В одну пробирку прилить раствор NaOH, а в другую – KI. Что происходит? Написать уравнение диссоциации комплексного иона[Ag(NH3)2]+ и выражение его константы нестойкости. Дать объяснение наблюдаемым явлениям, пользуясь уравнением диссоциации комплексного иона и правилом произведения растворимости.
д) Получение тиосульфатного комплекса серебра.
Получить в пробирке осадок AgCl. Затем добавлять раствор Na2S2O3 (Сэкв = 1,0 моль(экв)/л) до полного растворения осадка. Написать уравнение реакции образования Na3[Ag(S2O3)2].
К полученному раствору комплексного соединения
е) Сравнительная устойчивость тиоцианатного комплекса кобальта в воде и в спирте
Получить в пробирке тетратиоцианатокобальтат (II) аммония (NH4)2[Co(SCN)4], добавляя к 7 – 8 каплям насыщенного раствора хлорида кобальта (II) равный объем насыщенного раствора тиоцианата аммония. Наблюдать появление ярко-синей окраски комплексного соединения. Разделить раствор на 2 пробирки; в одну из них добавить амиловый спирт, в другую – 10 капель воды. Как изменяется окраска в каждой пробирке?
Написать уравнения реакций; образования комплексного соединения, его диссоциации и диссоциации комплексного иона. В воде или в спирте диссоциация комплексного иона протекает полнее? Чем это объясняется?
ж) Разрушение комплекса при осаждении комплексообразователя
В две пробирки с раствором сульфата меди добавить: в одну раствор оксалата аммония, в другую – сульфида аммония. Написать уравнения реакций и отметить цвета выпавших осадков. В двух других пробирках получить комплексное соединение меди, добавив к 4 – 5 каплям раствора CuSO4 (Сэкв = 1,0 моль(экв)/л) раствор аммиака до растворения выпадающего вначале осадка основной соли меди. Отметить цвет полученного комплексного соединения. Написать уравнение реакции взаимодействия сульфата меди с аммиаком, учитывая, что координационное число меди равно четырем.
Испытать действие растворов оксалата аммония и сульфида аммония на полученный раствор комплексной соли меди. От действия какого реактива выпадает осадок? На присутствие каких ионов в растворе комплексной соли указывает появление этого осадка? Добавить в пробирку, где выпал осадок, еще 6 – 7 капель того же реактива и для ускорения коагуляции осторожно нагреть. Сохранилась ли в растворе окраска комплекса меди?
Описать наблюдаемые явления. Ответить на поставленные по ходу работы вопросы. Написать уравнения проделанных реакций, уравнение электролитической диссоциации комплексной соли меди и ее комплексного иона. Как влияет добавление (NH4)2S на диссоциацию комплексного иона? Почему при добавлении оксалата аммония осадок не выпадает? Сравнить по табл. произведение растворимости соответствующих солей меди.
Опыт 9. двойные соли
В трех пробирках приготовить раствор двойной соли (NH4)2SO4 · FeSO4 · 6H2O (соли Мора), внеся в каждую по 6 – 8 капель воды и по одному микрошпателю соли. В одну пробирку к раствору соли Мора добавить 5 – 6 капель раствора сульфида аммония, в другую – столько же раствора хлорида бария. Выпавший черный осадок представляет собой сульфид железа (II). Отметить цвет осадков и написать ионные уравнения реакций их образования. На присутствие каких ионов в растворе двойной соли указывают эти реакции?
В третью пробирку добавить 7 – 8 капель раствора едкого натра (Сэкв = 2,0 моль(экв)/л) и, укрепив в штативе, опустить ее в водяную баню, нагретую почти до кипения. Подержать над пробиркой красную лакмусовую бумажку, смоченную водой. По изменению окраски лакмуса и по запаху определить, какой газ выделяется из пробирки. Написать ионное уравнение реакции его образования. На присутствие каких ионов в растворе двойной соли указывает эта реакция?
Учитывая результаты опыта, написать уравнение электролитической диссоциации соли Мора.
Проверить действием раствора сульфида аммония, обнаруживаются ли ионы Fe2+в растворе K4[Fe(CN)6]. Наблюдается ли выпадение черного осадка FeS? Почему?
Описать наблюдаемые явления. Ответить на вопросы, поставленные по ходу работы, и написать уравнения соответствующих реакций. Написать уравнение электролитической диссоциации K4[Fe(CN)6]. Чем отличается электролитическая диссоциация двойной соли от диссоциации соли, содержащей устойчивый комплексный ион?
Семейство железа.
Лабораторная работа №2
Цель: 1) изучить отношение железа к кислотам;
2) исследовать кислотно-основные и окислительно-восстановительные свойства соединений элементов семейства железа;
3) выяснить способность соединений железа, кобальта, никеля к комплексообразованию.
Опыт 11. получение ферратов
(Работу проводить в вытяжном шкафу)
Поместить в пробирку немного измельченного гидроксида калия (не содержащего карбоната), добавить к нему 3 – 5 капель раствора FeCl3 и 2 – 3 капли брома и нагреть. Отметить цвет образовавшегося феррата калия. Написать уравнение реакции.
Марганец и его соединения.
Лабораторная работа №3
Цель: 1) изучить отношение марганца и его соединений к кислотам и щелочам;
2) выяснить кислотно-основный характер соединений марганца в различных степенях окисления;
3) исследовать роль среды на поведение соединений марганца в окислительно-восстановительных реакциях.
Хром и его соединения.
Лабораторная работа №4
Цель: изучить зависимость свойств соединений хрома в различных степенях окисления от реакции среды.
Цинк, кадмий, ртуть.
Лабораторная работа №5
Цель: исследовать свойства цинка, кадмия, ртути и их соединений.
Опыт 12. получение каломели
Из растворимой соли ртути (I) получить каломель. Написать уравнение реакции.
МЕДЬ, серебро, золото.
Лабораторная работа №6
Цель: 1) экспериментальным путем исследовать свойства меди и её соединений;
2) изучить свойства соединений серебра.
Опыт 1. свойства меди
(Работу проводить в вытяжном шкафу)
а) Взаимодействие меди с кислотами
К небольшому количеству медных стружек прилить в отдельных пробирках разбавленные и концентрированные растворы кислот HCl, H2SO4 и HNO3.
Наблюдать происходящие явления. Те пробирки, в которых реакция не началась, нагреть (осторожно!). Со всеми ли кислотами взаимодействует медь? Обратить внимание на окраску раствора. Присутствие какого иона обусловливает эту окраску? Определить по характерному запаху и окраске выделяющиеся в результате реакции газы.
Написать уравнения реакций, объяснить подбор коэффициентов.
Сделать вывод о восстановительных свойствах меди.
б) Взаимодействие меди с ионами менее активных металлов
Пользуясь электрохимическим рядом напряжений металлов, определить, ионы каких металлов в растворах их солей способны окислять медь.
В раствор нитрата ртути (II) опустить конец медной проволоки, предварительно зачищенной наждачной бумагой. Какие наблюдаются признаки протекания химической реакции? Написать уравнение реакции.
Комплексной соли меди (II)
К раствору сульфата меди (II) добавлять по каплям раствор аммиака до растворения выпадающего вначале осадка основной соли. Написать уравнения реакций. В состав какого иона входят атомы меди? Каков цвет образовавшегося иона? Составить уравнение электролитической диссоциации образовавшейся комплексной соли и написать выражение константы нестойкости комплексного иона. Доказать опытным путем, что в растворе имеются сульфат-ионы.
Пользуясь таблицей произведения растворимости, подобрать реактив, с помощью которого можно обнаружить ионы меди (II) в растворе комплексной соли.
Опыт 5. галогениды серебра
а) Получить галогениды серебра. Обратить внимание на характер и цвет полученных соединений. Написать уравнения реакций. Испытать отношение осадков к HNO3. Почему галогениды серебра не растворяются в HNO3?
б) Получить осадки галогенидов серебра, отфильтровать и промыть водой. Испытать действие на них света (лучше прямого солнечного). Написать уравнения реакций.
ПРИЛОЖЕНИЯ
Таблица 1.
Таблица 2.
Обозначения: р – растворимое вещество (больше 10 г на 1000 г воды); м – малорастворимое вещество (от 10 до 0,01 г на 1000 г воды); н – практически нерастворимое (меньше 0,01 г на 1000 г воды); черта означает, что вещество не существует или разлагается водой.
Таблица 3.
Растворимость в воде солей и оснований (при 18°С)
| Анионы | Катионы | ||||||||
| Na+ | K+ | Ag+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Zn2+ | Pb2+ | |
| F– Cl– Br– I– NO3– ClO3– SO42– CO32– CrO42– C2O42– OH– | 4,44 35,86 88,76 177,9 83,97 97,16 16,83 16,39 61,21 3,34 116,4 | 92,56 32,95 65,86 137,5 30,34 6,6 11,11 108,0 63,1 30,27 142,9 | 195,4 1,6·10–4 1·10–5 3,5·10–7 213,4 12,25 0,55 0,003 0,0025 0,0035 0,01 | 0,0076 55,80 103,1 148,2 74,3 126,4 35,43 0,01 73,0 0,03 0,001 | 0,0016 73,19 143,3 121,8 179,3 0,20 0,0013 0,4 5,6·10–4 0,17 | 0,012 51,09 96,52 169,2 66,27 174,9 0,011 0,0011 0,12 0,0046 0,77 | 0,16 37,24 103,6 201,4 8,74 35,42 2,3·10–4 0,0023 3,8·10–4 0,0086 3,7 | 0,005 203,9 478,2 419,0 117,8 183,9 53,12 0,004 – 0,0006 0,0005 | 0,07 1,49 0,598 0,08 51,66 150,6 0,0041 0,0001 0,00002 1,5·10–4 0,01 |
Таблица 4.
ω (%) и плотность растворов солей (при 20°С)
| ω (%) | Плотность растворов солей, г/см3 | ω (%) | Плотность растворов солей, г/см3 | ||||
| NaCl | Na2CO3 | BaCl2 | NaCl | Na2CO3 | BaCl2 | ||
| 1,005 1,013 1,027 1,041 1,056 1,071 | 1,009 1,019 1,040 1,061 1,082 1,103 | – 1,016 1,034 1,053 1,072 1,092 | 1,086 1,101 1,116 1,132 1,148 1,164 | 1,124 1,146 | 1,113 1,134 1,156 1,179 1,203 1,228 |
В таблицах 4, 5 приведена относительная плотность 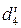 , т. е. плотность раствора при t°C, относящаяся к плотности воды при 4°C.
, т. е. плотность раствора при t°C, относящаяся к плотности воды при 4°C.
Таблица 5.
ω (%) и плотность раствора кислот и щелочей (при 15°С)
| ω (%) | Плотность раствора, г/см3 | ||||||
| H2SO4 | HNO3 | HCl | CH3COOH | KOH | NaOH | NH3 | |
| 1,027 1,055 1,083 1,112 1,143 1,174 1,205 1,238 1,273 1,307 1,342 1,380 1,419 1,460 1,503 1,547 1,594 1,640 1,687 1,732 1,776 1,808 1,830 1,840 1,838 | 1,022 1,044 1,068 1,093 1,119 1,145 1,171 1,198 1,225 1,251 1,277 1,303 1,328 1,351 1,373 1,394 1,412 1,429 1,445 1,460 1,474 1,486 1,496 1,504 1,522 | 1,019 1,039 1,059 1,079 1,100 1,121 1,142 1,163 1,183 | 1,0052 1,0113 1,0171 1,0228 1,0284 1,0337 1,0388 1,0436 1,0481 1,0523 1,0562 1,0598 1,0631 1,0660 1,0685 1,0707 1,0725 1,0740 1,0747 1,0748 1,0742 1,0726 1,0696 1,0644 1,0553 | 1,033 1,065 1,100 1,137 1,176 1,217 1,263 1,310 1,358 1,411 1,460 1,511 1,564 1,616 | 1,046 1,092 1,137 1,181 1,225 1,268 1,310 1,352 1,395 1,437 1,478 1,519 1,560 1,601 1,643 | 0,983 0,967 0,953 0,939 0,926 0,913 0,903 0,893 0,884 |
Таблица 6.
Концентрация и плотность кислот и оснований при 20°С
| ω , % | H2SO4 | HCl | HNO3 | H3PO4 | CH3COOH | NaOH | KOH | растворNH3 |
| 1,005 1,012 1,018 1,025 1,032 | 1,003 1,008 1,013 1,018 1,023 | 1,004 1,009 1,015 1,020 1,026 | 1,004 1,009 1,015 1,020 1,026 | 1,000 1,001 1,003 1,004 1,006 | 1,010 1,021 1,032 1,043 1,054 | 1,007 1,017 1,026 1,035 1,044 | 0,994 0,990 0,985 0,981 0,977 | |
| 1,039 1,045 1,052 1,059 1,066 | 1,028 1,033 1,038 1,043 1,047 | 1,031 1,037 1,043 1,049 1,054 | 1,031 1,037 1,042 1,048 1,053 | 1,007 1,008 1,010 1,011 1,013 | 1,065 1,076 1,087 1,098 1,109 | 1,053 1,062 1,072 1,081 1,090 | 0,973 0,969 0,965 0,961 0,958 | |
| 1,080 1,095 1,109 1,124 1,139 | 1,057 1,068 1,078 1,088 1,098 | 1,066 1,078 1,090 1,103 1,115 | 1,065 1,076 1,088 1,101 1,113 | 1,015 1,018 1,021 1,024 1,026 | 1,131 1,153 1,175 1,197 1,219 | 1,109 1,128 1,148 1,167 1,186 | 0,950 0,943 0,936 0,930 0,923 | |
| 1,155 1,170 1,186 1,202 1,219 | 1,108 1,119 1,129 1,139 1,149 | 1,128 1,140 1,153 1,167 1,180 | 1,126 1,140 1,153 1,167 1,181 | 1,029 1,031 1,034 1,036 1,038 | 1,241 1,263 1,285 1,306 1,328 | 1,206 1,226 1,247 1,267 1,288 | 0,916 0,910 0,904 0,898 0,892 | |
| 1,260 1,303 1,348 | 1,174 1,198 | 1,214 1,246 1,278 | 1,216 1,254 1,293 | 1,044 1,049 1,053 | 1,380 1,430 1,478 | 1,341 1,396 1,452 | ||
| 1,395 1,445 1,498 | 1,310 1,339 1,367 | 1,335 1,379 1,426 | 1,058 1,061 1,064 | 1,525 | 1,511 | |||
| 1,553 1,611 1,669 | 1,391 1,413 1,434 | 1,476 1,526 1,579 | 1,067 1,069 1,070 | |||||
| 1,727 1,779 1,814 | 1,452 1,469 1,483 | 1,633 1,689 1,746 | 1,070 1,069 1,066 | |||||
| 1,824 1,831 1,836 | 1,487 1,491 1,495 | 1,770 1,794 1,819 | 1,064 1,062 1,059 | |||||
| 1,836 1,831 | 1,501 1,513 | 1,844 1,870 | 1,055 1,050 |
Таблица 7.
Таблица 8.
Таблица 9.
Стандартные электродные потенциалы некоторых окислительно-восстановительных систем:
(г) – газ; (ж) – жидкость; (тв) – твёрдое вещество
| Окисленная форма | Восстановленная форма | Уравнение реакции | Е°, В |
| Li+ | Li (тв) | Li+ + e– ↔ Li | –3,02 |
| K+ | K (тв) | K+ + e– ↔ K | –2,92 |
| Ba2+ | Ba (тв) | Ba2+ + 2e– ↔ Ba | –2,90 |
| Sr2+ | Sr (тв) | Sr2+ + 2e– ↔ Sr | –2,89 |
| Ca2+ | Ca (тв) | Ca2+ + 2e– ↔ Ca | –2,87 |
| Na+ | Na (тв) | Na+ + e– ↔ Na | –2,71 |
| Mg2+ | Mg (тв) | Mg2+ + 2e– ↔ Mg | –2,34 |
| Al3+ | Al (тв) | Al3+ + 3e– ↔ Al | –1,67 |
| Mn2+ | Mn (тв) | Mn2+ + 2e– ↔ Mn | –1,05 |
| SO42– | SO32– | SO42– + 2e– + H2O ↔ SO32– + 2OH– | –0,90 |
| NO3– | NO2 (г) | NO3– + e– + H2O ↔ NO2 + 2OH– | –0,85 |
| Zn2+ | Zn (тв) | Zn2+ + 2e– ↔ Zn | –0,76 |
| Cr3+ | Cr (тв) | Cr3+ + 3e– ↔ Cr | –0,71 |
| AsO43– | AsO2– | AsO43– + 2e– + 2H2O ↔ AsO2– + 4OH– | –0,71 |
| Fe(OH)3 | [Fe(OH)2] (тв) | Fe(OH)3 + e– ↔ [Fe(OH)2] + OH– | –0,56 |
| Fe2+ | Fe (тв) | Fe2+ + 2e– ↔ Fe | –0,44 |
| Cd2+ | Cd (тв) | Cd2+ + 2e– ↔ Cd | –0,40 |
| Co2+ | Co (тв) | Co2+ + 2e– ↔ Co | –0,28 |
| Ni2+ | Ni (тв) | Ni2+ + 2e– ↔ Ni | –0,25 |
| NO3– | NO (г) | NO3– + 3e– + 2H2O ↔ NO + 4OH– | –0,14 |
| Sn2+ | Sn (тв) | Sn2+ + 2e– ↔ Sn | –0,14 |
| Pb2+ | Pb (тв) | Pb2+ + 2e– ↔ Pb | –0,13 |
| CrO42– | Cr(OH)3 | CrO42– + 2e– + 4H2O ↔ Cr(OH)3 + 5OH– | –0,12 |
| 2H+ | H2 | 2H+ + 2e– ↔ H2 | ±0,00 |
| NO3– | NO2– | NO3– + 2e– + H2O ↔ NO2– + 2OH– | +0,01 |
| S (тв) | H2S | S + 2e– + 2H+ ↔ H2S | +0,14 |
| Sn4+ | Sn2+ | Sn4+ + 2e– ↔ Sn2+ | +0,15 |
| Co(OH)3 | Co(OH)2 | Co(OH)3 + e– ↔ Co(OH)2 + OH– | +0,20 |
| SO42– | H2SO3 | SO42– + 2e– + 4H+ ↔ H2SO3 + H2O | +0,20 |
| Cu2+ | Cu (тв) | Cu2+ + 2e– ↔ Cu | +0,34 |
| Co3+ | Co (тв) | Co3+ + 3e– ↔ Co | +0,43 |
| H2SO3 | S (тв) | H2SO3 + 4e– + 4H+ ↔ S + 3H2O | +0,45 |
| Ni(OH)3 | Ni(OH)2 | Ni(OH)3 + e– ↔ Ni(OH)2 + OH– | +0,49 |
| ClO4– | Cl– | ClO4– + 8e– + 4H2O ↔ Cl– + 8OH– | +0,51 |
| I2 | 2I– | I2 + 2e– ↔ 2I– | +0,53 |
| MnO4– | MnO42– | MnO4– + e– ↔ MnO42– | +0,54 |
| MnO4– | MnO2 (тв) | MnO4– + 3e– + 2H2O ↔ MnO2 + 4OH– | +0,57 |
| MnO42– | MnO2 (тв) | MnO42– + 2e– + 2H2O ↔ MnO2 + 4OH– | +0,58 |
| BrO3– | Br– | BrO3– + 6e– + 3H2O ↔ Br– + 6OH– | +0,60 |
| O2 | H2O2 | O2 + 2e– + 2H+ ↔ H2O2 | +0,68 |
| H2SeO3 | Se | H2SeO3 + 4e– + 4H+ ↔ Se + 3H2O | +0,74 |
| Fe3+ | Fe2+ | Fe3+ + e– ↔ Fe2+ | +0,77 |
| NO3– | NO2 (г) | NO3– + e– + 2H+ ↔ NO2 + H2O | +0,81 |
| Продолжение | |||
| Окисленная форма | Восстановленная форма | Уравнение реакции | Е°, В |
| NO3– | NH4+ | NO3– + 8e– + 10H+ ↔ NH4+ + 3H2O | +0,87 |
| NO3– | NO (г) | NO3– + 3e– + 4H+ ↔ NO + 2H2O | +0,96 |
| HNO2 | NO (г) | HNO2 + e– + H+ ↔ NO + H2O | +0,99 |
| Br2 (ж) | 2Br– | Br2 + 2e– ↔ 2Br– | +1,08 |
| IO3– | I– | IO3– + 6e– + 6H+ ↔ I– + 3H2O | +1,09 |
| MnO2 (тв) | Mn2+ | MnO2 + 2e– + 4H+ ↔ Mn2+ + 2H2O | +1,28 |
| ClO4– | Cl– | ClO4– + 8e– + 8H+ ↔ Cl– + 4H2O | +1,34 |
| Cl2 (г) | 2Cl– | Cl2 + 2e– ↔ 2Cl– | +1,36 |
| Cr2O72 | 2Cr3+ | Cr2O72 + 6e– + 14H+ ↔ 2Cr3+ + 7H2O | +1,36 |
| ClO3– | Cl– | ClO3– + 6e– + 6H+ ↔ Cl– + 3H2O | +1,45 |
| PbO2 (тв) | Pb2+ | PbO2 + 2e– + 4H+ ↔ Pb2+ + 2H2O | +1,46 |
| HClO | Cl– | HClO + 2e– + H+ ↔ Cl– + H2O | +1,50 |
| MnO4– | Mn2+ | MnO4– + 5e– + 8H+ ↔ Mn2+ + 4H2O | +1,52 |
| H2O2 | H2O | H2O2 + 2e– + 2H+ ↔ 2H2O | +1,77 |
| Co3+ | Co2+ | Co3+ + e– ↔ Co2+ | +1,84 |
| F2 (г) | 2F– | F2 + 2e– ↔ 2F– | +2,85 |
Таблица 10.
ЛИТЕРАТУРА
Основная литература:
1. Практикум по неорганической химии: учеб. пособие для студентов пед. институтов. / Л.В. Бабич, С.А. Балезин, Ф.Б. Глинка и др. – М.: Просвещение, 1991. – 320 с.
2. Васильева З.Г., Грановская А.А., Таперова А.А.. Лабораторные работы по общей и неорганической химии. / З.Г. Васильева, А.А. Грановская, А.А. Таперова. – М.: химия, 1979. – 336 с.
3. Коровин Н. В.Лабораторные работы по химии / Н. В. Коровин, Э. И. Мингулина, Н. Г Рыжова. – М.: Высшая школа, 1998. – 256 с.
Дополнительная литература:
1. Ахметов Н.С. Общая и неорганическая химия: учебник для вузов / Н.С. Ахметов. – М: Высшая школа, 2003. – 743 с.
2. Общая и неорганическая химия: учебник для вузов: в 2-х т. / под ред. А.Ф. Воробьева. – М.: Академкнига, 2007. Т. 1: Теоретические основы химии. – 2007. – 371 с.
3. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии: учеб. пособие для студентов. / З.Е. Гольбрайх, Е.И. Маслов. – М.: Высшая школа, 2004. – 383 с.
4. Гончаров Е.Г. Строение вещества и химическая связь в курсе неорганической химии: учеб. пособие / Е.Г. Гончаров, Ю.П. Афиногенов, А.М. Ховив. — Воронеж: ИПЦ ВГУ, 2008. — 280 с.
5. Коржуков Н.Г. Общая и неорганическая химия. / Н.Г. Коржуков. – М.: МИСИС, 2004.– 511 с.
6. Коровин Н.В. Общая химия: учебник для студ. вузов, обучающихся по тех. направлениям и спец. / Н.В. Коровин. – М.: Высш. шк., 2007. – 557 с.
7. Лидин Р.А., Молочко В.А., Андреева Л.Л. Реакции неорганических веществ: справочник. / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева. – М.: Дрофа, 2007. – 637 с.
8. Павлов Н.Н. Общая и неорганическая химия. / Н.Н. Павлов. – СПб.: Лань, 2011. – 496 с.
9. Пузаков С. А., Попков В. А., Филиппова А. А. Сборник задач и упражнений по общей химии: учебное пособие для вузов. / С. А. Пузаков, В. А. Попков, А. А. Филиппова. – М.: Юрайт Издательство ООО, 2012. – 255 с.
10. Третьяков Ю.Д. Неорганическая химия. Т. 1 – 3. / под. ред. Ю.Д. Третьякова. – М.: Академия, 2004 – 2007. Т. 1 – 240 с, Т. 2 – 368 с, Т.3. – 352 с.
11. Угай Я.А. Общая и неорганическая химия: учебник для студентов вузов. / Я.А. Угай. – М: Высшая школа, 2004. – 527 c.
12. Фримантл М. Химия в действии. / М. Фримантл. – М.: Мир, 1998. – Ч. 1. – 528 с. – Ч. 2. – 620 с.
13. Эмсли Дж. Элементы: Пер. с англ. / Дж. Эмсли. – М.: Мир, 1993. – 255 с.
14. Дроздов А.А., Дроздова М.В.. Неорганическая химия. / А.А. Дроздов, М.В. Дроздова. – Саратов: Научная книга, 2012. [электронный ресурс]: http://www.iprbookshop.ru/neorganicheskaya-ximiya.-uchebnoe-posobie.html (16.10.12 г.)
15. Елфимов В.И., Бережной А.И., Аликина И.Б., Ярошинский А.И.. Общая и неорганическая химия. / В.И. Елфимов, А.И. Бережной, И.Б. Аликина, А.И. Ярошинский. – М.: Высшая школа, Абрис: 2012. [электронный ресурс]: http://w
