Кривая титрования раствора соли слабого электролита
Рассмотрим в качестве примера кривую титрования раствора соды. Так как ионы слабой угольной кислоты связывают катионы Н+, карбонатные растворы можно титровать кислотами. Нейтрализация протекает в две ступени, соответственно, на кривой титрования выделяют две эквивалентные точки. Результаты расчёта титрования аликвоты объёмом 10 мл 0,1 M раствора соды 0,1 M соляной кислотой приведены ниже.
Расчёт кривой титрования 10 мл 0,1 М раствора карбоната натрия 0,1 н. соляной кислотой:
| VNaOH, мл | Система | Расчётная формула | рН |
| Гидролизующаяся соль Na2CO3 | 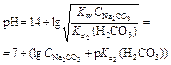 | 11,66 |
| VNaOH, мл | Система | Расчётная формула | рН |
| Титрование соды по первой ступени. | Буферный раствор H2CO3 + NaHCO3  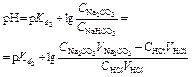 | 10,93 | |
| 10,33 | |||
| 9,96 | |||
| 9,38 | |||
| 9,5 | 9,05 | ||
| Первая точка эквивалентности VЭ,1 = 10 мл, VΣ1 = 20 мл | Гидролиз NaHCO3 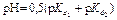 | 8,34 | |
| Титрование соды по второй ступени. | Буферный раствор NaHCO3 + Na2CO3  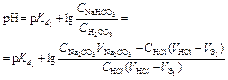 | 7,30 | |
| 6,95 | |||
| 6,35 | |||
| 5,98 | |||
| 5,40 | |||
| 19,5 | 5,07 | ||
| Вторая точка эквивалентности VЭ,2 = 20 мл, VΣ,2 = 30 мл | Раствор Н2CO3 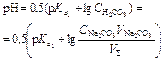 | 3,91 | |
| Избыток соляной кислоты | 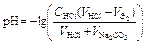 | 2,71 | |
| 2,41 | |||
| 2,04 | |||
| 1,91 | |||
| 1,78 |
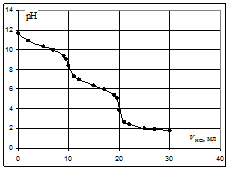
Кривая титрования соды кислотой
На кривой титрования выделяются две эквивалентные точки. Скачки рН в них невелики, менее 2 единиц. Первую точку эквивалентности можно определить по обесцвечиванию фенолфталеина при рН=8,3, вторую – по переходу окраски метилового оранжевого из жёлтой в красную в области рН около 3,7.
Окислительно-восстановительное титрование
Аналитическая реакция – окислительно-восстановительная. В зависимости от титранта можно выделить следующие виды редоксиметрии:
Перманганатометрия – титрование раствором KMnO4 в кислой среде. Восстановление титранта протекает по реакции:
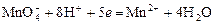 ,
,
в ходе которой малиновый раствор перманганата обесцвечивается. От первой избыточной капли титранта появляется розовая окраска, по которой отмечают эквивалентную точку.
Дихроматометрия – титрование раствором K2Cr2O7 в кислой среде. Дихромат калия восстанавливается по реакции:
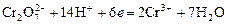 .
.
Ванадатометрия – титрование кислым раствором ванадата аммония по реакции:
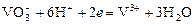 .
.
Йодометрия – титрование раствором йода. Часто применяют метод обратного титрования – к аликвоте пробы добавляют избыток титрованного раствора йода, а затем оттитровывают избыточный йод раствором тиосульфата натрия.
Восстановительное титрование растворами соли Мора, как часто называют сульфат железа (2+), тиосульфата натрия и др.
При расчёте результатов окислительно-восстановительного титрования нормальные концентрации титранта и определяемого элемента выражают в электрохимических эквивалентах на литр. Электрохимический эквивалент равен молярной массе соединения, делённой на число электронов в полуреакции его восстановления или окисления. Например, электрохимический эквивалент перманганата калия равен молярной массе, делённой на 5, тогда как химический эквивалент этого соединения в обменной реакции равен его молярной массе.
Комплексонометрия
Аналитическая реакция – связывание определяемого элемента в растворимый комплекс. В качестве титрантов используют органические комплексоны с несколькими функциональными группами в молекуле, которые образуют с катионами металлов пяти- или шестичленные гетероциклы, называемые хелатами. Наиболее распространённый комплексон – дигидроэтилендиаминтетраацетат натрия, имеющий техническое название трилон Б. Формула трилона Б следующая:
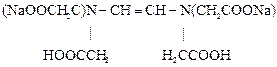
Образующийся в результате диссоциации в растворе анион дигидроэтилендиаминтетраацетата H2Tr2- реагирует с катионами металлов по уравнению:
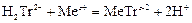 .
.
Как следует из уравнения реакции, она протекает не в эквивалентных, а в молярных соотношениях: 1 моль определяемого элемента на один моль трилона Б. Поэтому для расчёта результатов используют не нормальные, а молярные концентрации.
Индикаторы трилонометрического титрования – это слабые окрашенные органические кислоты, образующие с катионами металлов комплексы, менее устойчивые, чем комплексы с трилоном Б. При добавлении индикатора раствор окрашивается за счёт образования металл-индикаторного комплекса:
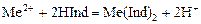 .
.
С индикатором связана малая часть катионов металла. Остальные катионы определяемого элемента в ходе титрования постепенно связываются в комплекс с трилоном. Когда все свободные катионы металла будут связаны с трилоном, он вытеснит индикатор из неустойчивого металл-индикаторного комплекса:
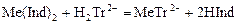 .
.
В результате окраска раствора изменяется, что позволяет установить эквивалентную точку.
