Iii. кривая титрования слабого основания сильной кислотой.
При построении кривой титрования слабого основания сильной кислотой исходят из тех же соображений, что и в случае титрования слабой кислоты щелочью. В первоначальный момент рН раствора определяется диссоциацией слабого основания. До точки эквивалентности в растворе будет присутствовать буферная смесь, состоящая из неоттитрованного слабого основания и его соли. В точке эквивалентности находится только соль слабого основания и сильной кислоты, которая подвергается гидролизу и создает кислую среду. За точкой эквивалентности рН определяется избыточным содержанием в растворе сильной кислоты.
Пример.
Построить кривую титрования 10,0 мл 0,1 М NH4OH раствором 0,1 М HCl.
Решение:
Расчетные данные приведены в табл.5.
В первоначальный момент (кислота не добавлена) рН раствора определяется по формуле
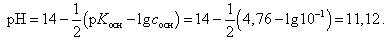 (19)
(19)
Таблица 5.
Расчет кривой титрования 10,0 мл 0,1 М NH4OH раствором 0,1 М HCl
| № | V(HCl),мл | 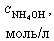 | 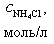 | 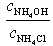 | [H+],моль/л | pH |
| 1. | 0,00 | 0,10 | - | - | - | 11,12 |
| 2. | 2,50 | 0,06 | 0,020 | 3,000 | - | 9,72 |
| 3. | 5,00 | 0,03 | 0,030 | 1,000 | - | 9,24 |
| 4. | 9,00 | 5 · 10 - 3 | 0,047 | 0,100 | - | 8,24 |
| 5. | 9,90 | 5 · 10 - 4 | 0,050 | 0,010 | - | 7,24 |
| 6. | 9,99 | 5 · 10 - 5 | 0,050 | 0,001 | - | 6,24 |
| 7. | 10,00 | - | 0,050 | - | - | 5,27 |
| 8. | 10,01 | - | 0,050 | - | 5 · 10- 5 | 4,30 |
| 9. | 10,10 | - | 0,050 | - | 5 · 10- 4 | 3,30 |
| 10. | 11,00 | - | 0,047 | - | 5 · 10- 3 | 2,30 |
| 11. | 15,00 | - | 0,040 | - | 0,02 | 1,70 |
При добавлении 9,0 мл 0,1 М HCl концентрация неоттитрованного слабого основания и его соли рассчитывается следующим образом:
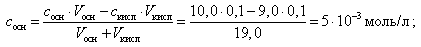 (20)
(20)
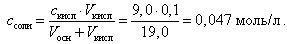 (21)
(21)
Расчет рН буферной смеси ведут по формуле
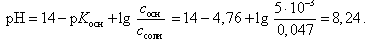 (22)
(22)
Аналогично рассчитывается рН в начале скачка на кривой титрования.
Значение рН в начале скачка на кривой титрования (добавлено 9,99 мл 0,1 М HCl) можно рассчитать с учетом следующих соображений: в растворе останется 0,1 % неоттитрованного одноосновного слабого основания и образуется 99,9 % соли:
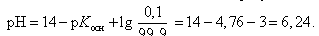
В точке эквивалентности (добавлено 10,0 мл 0,1 М HCl)
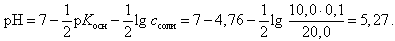 (23)
(23)
За точкой эквивалентности в растворе находится избыток сильной кислоты, следовательно, концентрация [H+]-ионов определяется по формуле (9).
Например, в конце скачка титрования (V(HCl) = 10,01 мл)
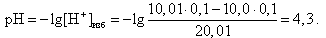
Внешний вид кривой титрования изображен на рис.3.
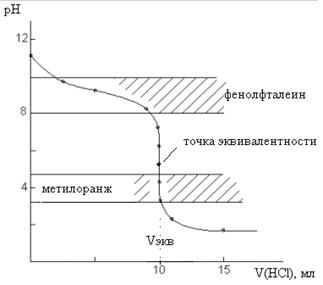
Рис.3. Кривая титрования 10 мл 0,1 М NH4OH раствором 0,1 М HCl
Анализ кривой титрования
При титровании слабого основания сильной кислотой скачок на кривой титрования и точка эквивалентности лежат в кислой среде. В данном случае скачок лежит в интервале от 6,24 до 4,3. ΔрН составляет ~1,9 единиц, т. е. значительно меньше скачка на кривой титрования сильного основания сильной кислотой. В качестве индикатора можно использовать метиловый оранжевый, изменяющий окраску в этой области. Применять фенолфталеин нельзя, так как его интервал перехода окраски не попадает в область скачка не кривой титрования.
IV. Кривая титрования слабого основания слабой кислотой.
В этом случае практически отсутствует скачок на кривой титрования (например, титрование CH3COOH раствором NH4OH), поэтому такой метод не применим на практике.
Примеры решения задач
Пример 1.
Вычислите рН, рОН, [ОН-] спинномозговой жидкости, если [H+]=3.9·10-8моль/л.
Решение:
Согласно определению pH = -lg[H+] = -lg(3.9·10-8)= -lg3.9 -lg10-8=8-lg3.9=7.4
Показатель рОН легко найти, пользуясь соотношением рН+рОН=14.
Тогда получаем рОН=14-рН=14-7.4=6.6
Концентрацию гидроксильных ионов найдем, пользуясь определением рОН:
рОН=-lg[ОН-]=6.6; lg[ОН-]=-6.6; [ОН-] =10-6.6 = 2.5·10-7
или вспомним, что ионное произведение воды Кw=[H+]·[ОН-]=1·10-14, тогда
[ОН-]=1·10-14/[H+]= 1·10-14/3.9·10-8=0.25·10-6= 2.5·10-7
Ответ: 7.4; 6.6; 2.5·10-7
Пример 2.
Предскажите значение pH (больше 7, меньше 7, равно 7) в водных растворах следующих солей: KCl, Na2S, Fe(NO3)2, СН3СООNH4 .
Решение:
Различные соли создают кислую либо щелочную среду в водных растворах благодаря гидролизу. Не рассматривая механизм этого процесса, можно примерно предсказать результат, зная относительную силу кислот и оснований (аниона и катиона), которые образуют данную соль.
Вспомним основные сильные и слабые кислоты и основания.
Сильные кислоты (диссоциируют полностью): HClO4, HClO3, HNO3, H2SO4, HMnO4, HCl, HBr, HI. ( Большинство оксикислот, содержащих центральный атом в высшей степени окисления, а также все бескислородные кислоты, образованные элементами VIIA группы, за исключениемHF.)
Сильные основания (диссоциируют полностью): LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые кислоты (не подвергаются полной диссоциации): большинство органических кислот(CH3COOH, C6H5OH, …), некоторые минеральные кислоты (HClO2, HClO, HNO2, H2SO3, H2CO3, H2SiO3, H3PO3, H3BO3, H2S, HCN, HF,...)
Слабые основания (не подвергаются полной диссоциации): большинство органических оснований (C6H5NH2, (CH3)2NH,…), нерастворимые минеральные основания (Fe(OH)2, Pb(OH)2, Cu(OH)2,…), гидроксид аммония (NH4OH).
Так как KCl содержит остаток сильного основания КOH и сильной кислоты HCl, такая соль не подвергается гидролизу, среда остается нейтральной, pH = 7.
Na2S содержит катион сильного основания NaOH и анион слабой кислоты H2S, поэтому протекает гидролиз по аниону, pH>7, щелочная среда.
Fe(NO3)2 содержит остаток сильной кислоты HNO3 и слабого основания Fe(OH)2 , подвергается гидролизу по катиону, pH<7, кислая среда. Для СН3СООNH4 гидролиз протекает и по аниону, и по катиону, образуется нейтральная среда, так как в составе соли остатки двух слабых электролитов с равными значениями констант диссоциации.
Ответ: pH=7; pH>7; pH<7; pH=7.
Пример 3.
Раствор амидопирина оттитровали 0.1N раствором HCl. На титрование 1.0 мл лекарственного препарата было затрачено 2.16 мл кислоты. Найдите процентную концентрацию амидопирина, если его эквивалент равен 231.3 г/моль, плотность раствора принять равной 1 г/мл. Что можно сказать о значении pH в точке эквивалентности? Без построения кривой титрования, предположите, какой можно было бы использовать индикатор.
Решение:
По закону эквивалентов
CN(основания)·V(основания)=CN(кислоты)·V(кислоты),
поэтому в нашем случае С(ам.)·V(ам.)=C(HCl)·V(HCl), и получаем С(ам.)=2.16·0.1/1.0=0.216N
Для нахождения процентной концентрации найдем массу амидопирина в 100г (без учета плотности 100г=100мл=0.1л) раствора:
m= CN ·Э ·V= 0.216 ·231.3 ·0.1=4.996г
Таким образом, процентная концентрация амидопирина составляет 4.996 ≈5%
При титровании слабого органического основания сильной кислотой точка эквивалентности смещается в кислую область (pHт.экв.<7), поэтому рН перехода окраски индикатора (или его показатель титрования рТ) тоже должен находиться в этой области. В данном анализе применяется метиловый оранжевый (переход окраски желтый/красный в области рН=3.1-4.4). Для точного выбора индикатора обязательным условием является построение кривой титрования.
Ответ: 5%; pHт.экв.<7.
Задачи для самостоятельного решения
1. Найдите [H+], рН, [OH-], рОН следующих растворов кислот:
а) 0.001М НCl ; б) 0.005М Н2SO4 ; в) 0.1N Н2SO4.
2. Найдите [H+], рН, [OH-], рОН следующих растворов щелочей:
а) 0.001М KOH ; б) 0.005М Ba(OH)2 ; в) 0.1N Sr(OH)2.
3. Рассчитайте концентрацию гидроксильных ионов [OH-], а также значение pH
и pOH желчи, если [H+] = 1· 10-8 M (в желчных путях).
4. Рассчитайте [H+], [OH-] концентрации, а также значение pOH, если pH слюны равно 6.
5. pH крови в норме составляет 7.35. Найдите концентрации [H+], [OH-], а также значение pOH.
6. Чистый желудочный сок имеет pOH=13.1. Найдите концентрацию водородных ионов [H+].
7. Концентрация ионов водорода в женском молоке 2.5 · 10-7 моль/л. Найдите значение pH.
8. Расположите соединения в каждой группе по возрастанию кислотности, дайте соответствующее объяснение:
а) HCl, HI, HBr
б) HClO, HBrO, HIO
в) NaHSO3, NaHSeO3, NaHSO4
г) HF, H2O, NH3, CH4
д) HClO, HClO2, HClO3, HClO4
9. Найдите pH и pOH каждого раствора сильного электролита.
а) 0.1M HBr
б) 1.45M NaOH
в) 0.0071M Ba(OH)2
г) 0.03M HNO3
д) 0.0001M HCl
е) 0.05M H2SO4
ж) 0.001M NaOH
з) 0.005M Sr(OH)2
10. Найдите pH и pOH каждого раствора. (Даны только сильные электролиты.)
a) 0.1N HClO4 ; б) 0.01N KOH ; в) 0.01N H2SO4 ; г) 0.05M Ba(OH)2
11. Найдите pH и pOH каждого раствора кислоты:
а) 0.0092 M HClO, [H+] = 1.8·10-5 M
б) 0.081 M HCN, [H+] = 6·10-6 M
12. Найдите pH и pOH каждого раствора основания:
а) 0.0784 M C6H5NH2, [OH-] = 6.0·10-6 M
б) 0.1098 M (CH3)3N, [OH-] = 2.8·10-3 M
13. Подчеркните только сильные электролиты:
H2SO4, H2S, C2H5NH2, HClO4, LiOH, HNO2, Cu(OH)2, C6H5COOH, КОН
14. Подчеркните только слабые электролиты:
Ba(OH)2, CH3COOH, HF, H2SO3, HBr, HClO2, KI, NH4OH, KMnO4 , HI
15. Предскажите значение рН (pH<7, pH=7, pH>7) в следующих растворах солей: СuSO4, NaCl, Li2S, CaCl2, C6H5COONa (бензоат натрия), K2SiO3,
[C6H5NH3]Cl (хлорид фениламмония), C7H5O3Na (салицилат натрия).
16. Некоторые средства для очистки фарфора содержат гидросульфат натрия, NaHSO4. Является ли этот раствор кислотным или щелочным ? Эти чистящие средства эффективно удаляют отложения карбоната кальция, образовавшегося за счет жесткости водопроводной воды. Напишите основное химическое уравнение этого процесса удаления известковых отложений.
17. Можно ли определить концентрацию следующих растворов, используя водный раствор КОН с известной концентрацией? Если да, предположите, какой можно использовать индикатор и почему.
а) молочная кислота CH3-CH(OH)-COOH;
б) хлорная кислота HClO4;
в) борная кислота H3BO3.
18. Какие растворы можно выбрать для определения концентрации следующих лекарственных средств? Без построения кривых титрования, сделайте грубое предположение об индикаторах, которые можно было бы использовать в анализе.
Каким будет pH в точке эквивалентности (> 7, < 7, = 7) ?
а) димедрол (C6H5)2CH-O-(CH2)2-N (CH3)2 ;
б) аспирин CH3OCO(C6H4)-COOH ;
в) сульфаниламид H2N-C6H4SO2R ;
г) гидрокарбонат натрия NaHCO3 ;
д) щавелевая кислота H2C2O4 ;
е) бура Na2B4O7 ;
ж) цитрат натрия CitrNa ;
з) амидопирин.
19. На титрование 15.6мл 0.432N раствора HI расходуется 30.6мл раствора аммиака. Найдите нормальность (молярную концентрацию эквивалентов) раствора NH3 .
20. 0.366N раствор KOH титруют H2SO4. Если объем пробы КОН составляет 32.0 мл, какой объем 0.366 M серной кислоты потребуется для достижения точки эквивалентности? Изменится ли этот объем при использовании 0.366 N H2SO4 ? (При условии, что оба протона кислоты вступают в реакцию.)
21. Твердый гидроксид кальция, Ca(OH)2, оставили в воде до образования насыщенного раствора. На титрование 75.0 мл такого раствора 5.0·10-2 N раствором HCl затратили 36.6 мл кислоты.
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Найдите нормальность и молярность насыщенного раствора Ca(OH)2.
Какова растворимость Ca(OH)2 в г/л раствора?
22. Проба кислоты массой 0.1824г оттитрована 0.309N NaOH, при этом 9.256 мл было затрачено до достижения точки эквивалентности. Найдите:
а) эквивалент (молярную массу эквивалента) кислоты;
б) какая из кислот могла быть использована в этом титровании:
HCl, H3PO4, H2SO4, HNO3 или CH3COOH ? Обоснуйте ответ.
23. Какой объем 0.75N фосфорной кислоты H3PO4 потребуется для полной нейтрализации 0.5л 0.7M гидроксида калия?
24. Какова нормальность раствора H2SO4 , если 40.2 мл этого раствора способны полностью нейтрализовать 6.5г NaHCO3 ?
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + 2CO2
25. На титрование 0.45г кислоты было затрачено 282.0 мл 6·10-3N NaOH до достижения точки эквиваленитности. Найдите эквивалент (молярную массу эквивалента) кислоты.
26. Найдите нормальность 40% водного раствора серной кислоты с плотностью 1.305 г/мл.
27. Сколько миллилитров 1.5 M раствора KOH требуется для титрования 40.0 мл 0.0656 M раствора H3PO4 по реакции:
H3PO4 + 2KOH → K2HPO4 + 2H2O
28. На титрование 50.0 мл 0.105 M раствора LiOH было затрачено 46.28 мл раствора серной кислоты. Найдите молярность раствора кислоты, если реакция протекает по уравнению: H2SO4 + 2LiOH → Li2SO4 + 2H2O
29. Проба гидрофталата калия KHC8H4O4 массой 0.342г оттитрована 35.73 мл раствора NaOH. Найдите молярную концентрацию раствора щелочи.
KHC8H4O4 + NaOH → KNaC8H4O4 + H2O
30. Пробу желудочного сока (5.0мл) оттитровали 0.095 М раствором КОН в присутствии фенолфталеина. На титрование затратили 2.8 мл раствора щелочи. Найдите кислотность анализируемого сока в ммоль/л. Возможно ли определить общую кислотность при использовании метилового оранжевого вместо фенолфталеина? Дайте соответствующее объяснение.
31. Для нахождения суммарного количества яблочной кислоты в детском питании пробу оттитровали раствором KOH. Что можно сказать о значении pH в точке эквивалентности? Без построения кривой титрования, предположите, какой можно было бы использовать индикатор.
32. Смешали равные объемы 0.05 M H2SO4 и 0.4 M KOH. Найдите молярность каждого иона, присутствующего в растворе после смешения.
33. Какой объем 0.333M HNO3 потребуется для реакции с 1.25г гидрокарбоната натрия?
NaHCO3 + HNO3 → NaNO3 + CO2 + H2O
34. Какой объем 0.33 M раствора хлороводородной кислоты потребуется для полной нейтрализации 1.0 мл 0.215 M гидроксида бария Ba(OH)2?
35. Проба кислоты H2X массой 1.8 г требует 14.00 мл раствора KOH для полной нейтрализации ионов водорода. Известно, что 14.2 мл этого раствора KOH способны нейтрализовать 10.0 мл 0.75 M H2SO4. Найдите молекулярную массу H2X.
36. 0.3 л газообразного аммиака при температуре 28˚C и давлении 754 мм.рт.ст. растворили в 0.1 л воды. Какой объем 0.2 M хлороводородной кислоты требуется для нейтрализации такого раствора ? Найдите молярность раствора аммиака. (При условии отсутствия изменения в объеме при растворении).
37. Постройте теоретическую кривую титрования 20.0 мл 0.1 M HClO4 (сильной кислоты) 0.2 M KOH (сильным основанием).
38. На титрование 3 мл желудочного сока в присутствии индикатора метилового оранжевого затратили 1.25мл 0.1N раствора щелочи. Какая кислотность определена таким способом (свободная соляная кислота или общая кислотность)? Найдите соответствующий показатель кислотности в ммоль/л.
39. Проба неочищенного одноосновного амина была оттитрована до достижения точки эквивалентности. На титрование 0.5 г основания было затрачено 75.0 мл 0.1 M HCl. После добавления 40.0 мл кислоты показатель рН равнялся 10.65. Молекулярная масса чистого основания составляет 59.1. Найдите: a) константу ионизации основания; б) массовую долю чистого вещества; в) индикатор, наиболее подходящий для данного титрования. Обоснуйте свой выбор. Список индикаторов:
Метиловый оранжевый (pHизм.окр.= 3.1-4.4)
Метиловый красный (pHизм.окр.= 4.8-6.0)
Бромтимоловый синий (pHизм.окр.= 6.0-7.6)
Фенолфталеин (pHизм.окр.= 8.3-10.0)
Тимолфталеин (pHизм.окр.= 9.3-10.5)
40. Сделайте предположение, какой можно выбрать индикатор при титровании раствора буры (тетрабората натрия) соляной кислотой. Какое значение имеет рН (<7, =7, >7) в точке эквивалентности?
41. На титрование 10.0мл желудочного сока с метиловым оранжевым было затрачено 3.1мл титранта с концентрацией 0.0983N. На титрование с фенолфталеином ушло 6.0мл щелочи. Рассчитайте содержание HCl и общую кислотность в ммоль/л.
42. До какого объема нужно довести раствор, в котором содержится 1.53г NaOH, чтобы на титрование 20.0мл такого раствора пошло 14.7мл 0.104N раствора HCl ?
43. На титрование 5.0мл 0.1N раствора щавелевой кислоты израсходовали 5.5мл раствора КОН. Затем этим раствором щелочи оттитровали 2.0мл желудочного сока в присутствии фенолфталеина. На реакцию израсходовали 1.2мл щелочи. Рассчитать кислотность анализируемого сока в ммоль/л.
Тестовые задания
