Кривая титрования слабой многоосновной кислоты
Основное различие в расчетах кривой титрования одно- и многоосновных кислот связано со ступенчатой диссоциацией многоосновных кислот и, как следствие, с возможным существованием двух и более скачков титрования соответственно числу ступеней диссоциации.
Возможность титрования кислоты с заданной точностью по первой точке эквивалентности зависит от соотношения ступенчатых констант диссоциации кислоты.
Титрование кислоты состава H2An по первой ступени с погрешностью не более 1 % означает, что взаимодействие кислоты со щёлочью по первой ступени должно пройти не менее чем на 99 %, а по второй не более чем на 1 %. Такая ситуация возможна, если вторая константа диссоциации будет на 4 порядка меньше, чем первая. Если различие в константах диссоциации будет составлять 6 или более порядков, то погрешность определения может быть снижена до 0,1 %
Участки кривой титрования многоосновной кислоты рассчитываются по тем же формулам, что и для одноосновной кислоты. Ниже рассмотрены этапы титрования слабой трёхосновной кислоты.
1 этап. В растворе присутствует только слабая кислота, рН раствора определяется её концентрацией и первой константой диссоциации:
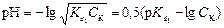 ,
,
где СK – концентрация раствора кислоты, моль/л.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью по первой ступени:
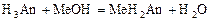 .
.
В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и кислой соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора:
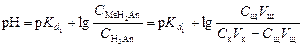 ,
,
где 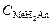 – концентрация кислой соли слабой кислоты,
– концентрация кислой соли слабой кислоты, 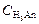 – остаточная концентрация слабой кислоты, VK – объём пробы кислоты, взятый для титрования, СЩ – концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленный в процессе титрования.
– остаточная концентрация слабой кислоты, VK – объём пробы кислоты, взятый для титрования, СЩ – концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленный в процессе титрования.
3 этап. Первая точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи 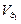 . В системе находится только кислая соль MeH2An. рН вычисляется по уравнению:
. В системе находится только кислая соль MeH2An. рН вычисляется по уравнению:
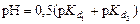 .
.
4 этап. Аналогичен второму этапу. Происходит нейтрализация кислоты щёлочью по второй ступени:
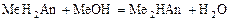 .
.
В результате образуется буферная смесь, состоящая из двух кислых солей. Более кислая соль будет играть роль кислоты, менее кислая – роль соли. рН вычисляется по уравнению для кислого буферного раствора:
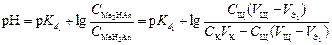 ,
,
5 этап. Вторая точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объем щёлочи 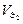 . В системе находится только кислая соль состава MeHx-2An. рН вычисляется по уравнению:
. В системе находится только кислая соль состава MeHx-2An. рН вычисляется по уравнению:
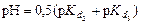 .
.
6 этап. Нейтрализация кислоты по третьей ступени:
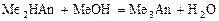 .
.
В результате образуется буферная смесь, состоящая из кислой и основной солей. Кислая соль будет играть роль кислоты, средняя – роль соли. рН вычисляется по уравнению для кислого буферного раствора:
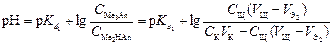 .
.
7 этап. Третья точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи 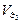 . В системе находится только средняя соль состава Me3An. рН вычисляется по уравнению для гидролизующейся по аниону соли:
. В системе находится только средняя соль состава Me3An. рН вычисляется по уравнению для гидролизующейся по аниону соли:
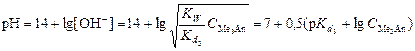 ,
,
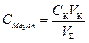 ,
,
где 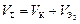 .
.
8 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи:
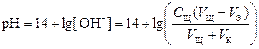 .
.
Расчёт кривой титрования 10 мл 0,1 н. раствора ортофосфорной кислоты 0,1 н. раствором гидроксида натрия.
| VNaOH, мл | Система | Расчётная формула | рН |
| 0,1 н. раствор H3PO4 | 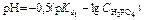 | 1,57 |
| VNaOH, мл | Система | Расчётная формула | рН |
| Первый этап титрования. | Образование буферного раствора H3PO4+NaH2PO4 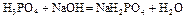 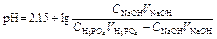 | 2,15 | |
| 2,52 | |||
| 3,10 | |||
| Первая точка эквивалентности. VЭ,1 = 10 мл, VΣ = 20 мл | Гидролиз соли NaH2PO4. 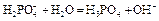 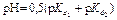 | 4,68 | |
| Второй этап титрования. | Образование буферного раствора NaH2PO4+Na2HPO4 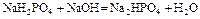 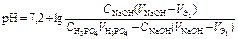 | 6,60 | |
| 7,20 | |||
| 7,57 | |||
| 8,15 | |||
| Вторая точка эквивалентности. VЭ,2 = 20 мл, VΣ = 30 мл | Гидролиз соли Na2HPO4. 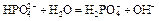 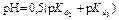 | 9,55 | |
| Третий этап титрования. | Образование буферного раствора: Na2HPO4+Na3PO4 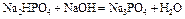 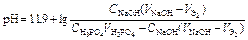 | 11,3 | |
| 11,9 | |||
| Третья точка эквивалентности. VЭ,3 = 30 мл, VΣ = 40 мл | Гидролиз соли Na3PO4. 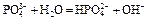 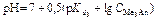 | 12,15 | |
| Избыток щёлочи | 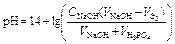 | 12,68 | |
| 13,05 | |||
| 13,17 | |||
| 13,30 | |||
| 13,44 | |||
| 13,52 |
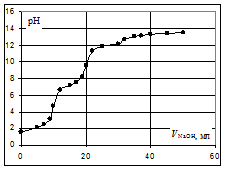
Кривая титрования ортофосфорной кислоты щёлочью
Следует отметить, что вследствие малой константы диссоциации кислоты по третьей ступени, на кривой титрования ортофосфорной кислоты можно выделить только 2 скачка значений рН, соответствующих двум эквивалентным точкам. Первую из них при рН около 4,7 удобно определять с помощью индикатора бромкрезолового зелёного по переходу окраски из жёлтой в голубую, вторую эквивалентную точку при рН в районе 9,6 можно определить с тимоловым голубым.
