Вычисление концентрации анализируемого раствора
Вычисление концентрации анализируемого раствора выполняется на основании закона эквивалентов для растворов.
Нормальную концентрацию вычисляют по уравнению:
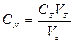 .
.
Молярную концентрацию рассчитывают по формуле:
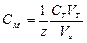 .
.
Массовую концентрацию вычисляют по уравнению:
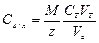 .
.
Вычисление массовой доли анализируемого вещества в сухой пробе
Для расчёта массовой доли анализируемого вещества в навеске сухой пробы можно воспользоваться уравнением:
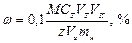 ,
,
где М – молярная масса анализируемого вещества, г/моль.
Кислотно-основное титрование
Аналитическая реакция – нейтрализация кислоты щёлочью или, наоборот, щёлочи кислотой. Эквивалентную точку определяют обычно с помощью цветных индикаторов.
Действие индикаторов
Индикаторами являются слабые органические кислоты или основания, у которых ионная и молекулярная формы имеют различную окраску. Например, фенолфталеин содержит фенольную функциональную группу, метилоранж – ароматическая сульфокислота с функциональной группой -SO3H. Процесс их диссоциации в общем виде можно представить уравнением:
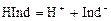 .
.
Константа диссоциации индикатора определяется уравнением:
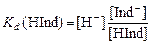 .
.
Концентрации ионной и молекулярной форм в середине области перехода окраски индикатора равны между собой и рН перехода окраски индикатора равен логарифму константы диссоциации:
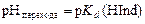 .
.
При 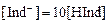 цвет раствора будет обусловлен окраской ионной формы индикатора и, наоборот, при
цвет раствора будет обусловлен окраской ионной формы индикатора и, наоборот, при 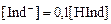 раствор будет окрашен молекулярной формой индикатора. Поэтому переход окраски происходит в области
раствор будет окрашен молекулярной формой индикатора. Поэтому переход окраски происходит в области 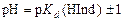 .
.
Фенолфталеин является очень слабой кислотой, поэтому он изменяет окраску от бесцветной к малиновой в слабощелочной области, при рН = 8,3 – 10. Метиловый оранжевый – кислота средней силы, изменяет окраску от красной к жёлтой в слабокислой области при рН = 3,7 – 5,1. Лакмус изменяет окраску от красной к синей в нейтральной области при рН около 7.
Кривые титрования
Кривые титрования – графические зависимости концентрации участника реакции, протекающей при титровании от объёма добавленного титранта. Для реакций кислотно-основного взаимодействия показателем концентрации участника реакции является рН раствора.
Различают теоретические и экспериментальные кривые титрования. Теоретический расчёт кривых титрования проводится по уравнению реакции и исходным концентрациям реагирующих веществ. Теоретические кривые титрования нужны для обоснованного выбора индикатора в данном титровании. Экспериментальные кривые титрования получают при измерении какого-либо свойства системы в ходе титрования (ЭДС, электропроводность и т.п.) в зависимости от объёма титранта. Экспериментальные кривые титрования нужны для определения точки эквивалентности.
Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора и выбрать наиболее подходящий индикатор для определения точки эквивалентности (конца титрования).
При построении теоретических кривых титрования рассчитывают рН четырёх основных этапов:
1) до начала титрования;
2) титрование до точки эквивалентности;
3) точка эквивалентности;
4) после точки эквивалентности.
