Атомная абсорбционная спектроскопия: теоретические основы метода, его возможности. Аналитические линии. Приемы количественных определенийМетод атомно-абсорбционной спектроскопии
Атомно-абсорбционная спектрофотометрия
Атомно-абсорбционная спектрофотометрия (ААС) – это современный, широко используемый метод определенияэлементного состава вещества по атомным спектрам поглощения.
Переход в атомное состояние происходит при распылении раствора пробы в высокотемпературное пламя, которое получают при горении ацетилена в воздухе или кислороде. Температура пламени в воздухе - 1900ºС , в кислороде - 3100ºС.
Через пламя пропускают излучение определенной для каждого химического элемента длины волны. Для этого используют специальные лампы, испускающие очень узкий пучок света известной интенсивности. Часть излучения поглощается химическим элементом, находящимся в пламени; интенсивность прошедшего света замеряется с помощью фотоэлементов.
ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА К оптическим методам анализа относят физико-химические методы, основанные на взаимодействии электромагнитного излучения с веществом. Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения излучения, отражения и рассеяния электромагнитного излучения. Оптические методы включают в себя большую группу спектральных методов анализа.
Метод молярного коэффициента поглощения.
Метод градуировочного графика.
Метод добавок.
Метод дифференциальной фотометрии.
11.Атомная эмиссионная спектроскопия: теоретические основы метода, основные узлы и общий принцип работы приборов. Эмиссионная фотометрия пламени: сущность метода, его возможности, основные характеристики линий спектра, качественный и количественный анализ, приемы определения неизвестной концентрации.
Атомно-эмиссионная спектроскопия (спектрометрия), АЭС или атомно-эмиссионный спектральный анализ — совокупность методов элементного анализа, основанных на изучении спектров испускания свободных атомов иионов
в газовой фазе (см. группу методов оптической спектроскопии)АЭС — способ определения элементного состава вещества по оптическим линейчатым спектрам излучения атомов и ионов анализируемой пробы, возбуждаемым в источниках света. В качестве источников света для атомно-эмиссионного анализа используют пламя горелки
ФОТОМЕТРИЯ ПЛАМЕНИ ЭМИССИОННАЯ
пламенная фотометрия), оптич. метод количеств. элементного анализа по атомным спектрам испускания.Для получения спектров анализируемое в-во переводят в атомный пар в пламени.
Пламенная фотометрия — один из видов атомно-эмиссионной спектроскопии. Применяется для определениящелочных
приемы определения неизвестной концентрации
Неизвестная концентрация равна концентрации стандартного раствора, окраска которого совпадает с окраской исследуемого раствора или находится между двумя ближайшими: более слабо и более сильно окрашенными.
Неизвестную концентрацию находят расчетным или графическим способами.
Расчетным способом определяют, сравнивая пики образца с пиками, полученными для растворов сравнения вводимых в систему тем же способом и в тех же объемах, что и анализируемые пробы.
Графически- откладывая по оси ординат значения lg /, а по оси абсцисс - соответствующие им концентрации IgC. Имея две или более проб с известными концентрациями, получают градуированную линию
Атомная абсорбционная спектроскопия: теоретические основы метода, его возможности. Аналитические линии. Приемы количественных определенийМетод атомно-абсорбционной спектроскопии
Метод основан на поглощении электромагнитного излучения свободными атомами в стационарном (невозбужденном) состоянии. При длине волны, соответствующей переходу атома из основного в возбужденное электронное состояние, заселенность основного уровня уменьшается. Аналитический сигнал зависит от числа невозбужденных частиц в анализируемом образце (т.е. от концентрации определяемого элемента), следовательно, измеряя количество поглощенного электромагнитного излучения можно определить концентрацию определяемого элемента в исходном образце
Распределение атомов по разным энергетическим уровням описывается распределением Больцмана, которое показывает, что при увеличении температуры заселенность уровня возрастает.
В атомно-абсорбционном спектральном анализе используются резонансные переходы (переходы между основным и первым возбужденным состоянием), потому что даже при очень больших температурах совсем незначительное число атомов переходит на возбужденный уровень.
Излучение, которое испускают атомы после фотонного возбуждения, называют флуоресценцией.
Методы абсорбционной спектроскопии имеют высокую чувствительность (низкий предел обнаружения), они избирательны и точны. Методы могут быть применены для анализа больших и малых содержаний, но особенно ценной их особенностью является возможность определения примесей (до -%). Важное значение имеет избирательность многих фотометрических методов, позволяющая проводить определения элементов в сложных пробах без химического разделения компонентов.
13.Молекулярная абсорбционная спектроскопия: теоретические основы метода, его возможности. Виды фотометрического анализа. Основные узлы и общий принцип работы приборов.
Принцип метода
Еще в начале XIX века концентрацию окрашенных растворов научились оценивать, сравнивая на глаз интенсивность их окраски с заранее приготовленной шкалой эталонных растворов (колориметрия). Затем были изобретены приборы для количественного измерения поглощения света растворами; установлены закономерности, связывающие характеристики светопоглощения с концентрацией окрашенных веществ. В XX веке подобным образом стали определять и концентрацию бесцветных растворов, их поглощение измеряли в УФ- или в ИК-области. В развитие молекулярно-абсорбционной спектроскопии большой вклад внесли физики П.Бугер (Франция), К.Фирордт (Германия), У.Кобленц (США). В зависимости от того, в какой области спектра измеряют аналитический сигнал, методы молекулярно-абсорбционной спектроскопии разделяют на две группы: 1) фотометрический анализ в УФ- и видимой области (спектрофотометрия); 2)ИК-спектроскопия. Соответствующие методы сильно различаются по своим возможностям, но основаны они на одних и тех же теоретических закономерностях.
Общие закономерности поглощения света. При пропускании монохроматического светового потока через кювету с раствором, содержащим молекулы или ионы Х, интенсивность светового потока уменьшается. Это связано с рядом причин: часть света поглощается молекулами или ионами Х, другая часть – растворителем и примесями, третья - рассеивается и отражается стенками кюветы. Чтобы учесть потери света, связанные с растворителем и кюветой, измерения проводят относительно раствора сравнения, не содержащего Х. Обычно в качестве раствора сравнения используют чистый растворитель. Если поместить и фотометрируемый раствор, и раствор сравнения в одинаковые кюветы, а затем через эти кюветы пропускать свет с одной и той же длиной волны l и одинаковой начальной интенсивностью Iнач, то потери света на отражение и рассеяние для обеих кювет окажутся одинаковы. Тогда различие в интенсивности получаемых световых потоков (I и I0) будет определяться лишь природой и концентрацией Х.
В качестве аналитического сигнала в молекулярно-абсорбционной спектроскопии используют оптическую плотность (А). Это десятичный логарифм отношения интенсивности монохроматического света, прошедшего через раствор сравнения, к интенсивности света, прошедшего через исследуемый раствор
(1) 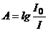
Оптическая плотность – безразмерная величина. Она не зависит от Iнач, а определяется природой и концентрацией частиц, поглощающих свет на данной длине волны, а также толщиной поглощающего слоя в кювете. Связь этих величин описывает основной закон светопоглощения, который принято называть законом Бугера – Ламберта - Бера:
В соответствии с этим законом, оптическая плотность раствора, измеренная на некоторой длине волны, прямо пропорциональна концентрации растворенного вещества, поглощающего свет на этой длине волны, и толщине слоя раствора.
А = ε l С (2)
Концентрацию поглощающих частиц (С) выражают в моль/л, толщину слоя ( l ) - в сантиметрах. В таком случае коэффициент пропорциональности e называют молярным коэффициентом поглощения. Его величина зависит от природы Х и длины волны, на которой измеряют оптическую плотность.
Аппаратура. Для измерения оптической плотности растворов и регистрации спектров поглощения используют спектрофотометры (рис.3). Важнейшая их часть - монохроматор. Другие узлы - источник света, приемник излучения и регистрирующее устройство.
Источники света. В зависимости от оптической области, в которой работает прибор, источниками света служат: в УФ-области – водородная или дейтериевая газоразрядные лампы, дающие сплошной спектр излучения; в видимой области – обычная лампа накаливания с вольфрамовой нитью, в ИК-области – глобар. Это керамический стержень, нагреваемый до температур порядка 1600 0С.
Монохроматоры. В спектрофотометрах применяют призменные монохроматоры или дифракционные решетки. Материал, из которого изготавливают оптическую систему прибора, должен хорошо пропускать свет в рабочем диапазоне длин волн. В УФ-области используют кварц, в видимой области – стекло, в ИК-области – кристаллические соли, галогениды щелочных и щелочноземельных металлов (NaCl, KBr, CaF2 ).
Прибор настраивают на нулевую оптическую плотность по кювете с раствором сравнения (4), а затем вместо нее вводят в световой поток кювету с исследуемым раствором (3). В результате меняется интенсивность светового потока, падающего на приемник излучения (фотоэлемент), меняется и величина фототока.
Фотометрический анализ
Чтобы выбрать оптимальные условия анализа, после проведения фотометрической реакции исследуют спектр поглощения полученного соединения. Вид конкретного спектра и значения вышеперечисленных характеристик определяются природой поглощающих частиц. Спектр поглощения отдельного раствора строят в координатах А - l. При изменении концентрации раствора спектральная кривая будет сдвигаться по вертикали (рис.4, слева), но число максимумов на этой кривой и их положение в шкале длин волн не изменятся. Длину волны, при которой наблюдается максимальное поглощение, обозначают как lmax , а молярный коэффициент на этой длине волны – как εmax. Зависимость ε от l (или lg ε от l) характеризует все растворы данного состава. Она не меняется при изменении концентрации растворенного вещества или толщины поглощающего слоя. Именно такие «обобщенные» спектры поглощения индивидуальных веществ приводят в спектральных атласах (рис.4, справа). Чем больше εmax, тем меньшие концентрации Х можно определять по данной методике.
Фотометрический анализ широко применяют в контрольно-аналитических лабораториях на предприятиях химической, пищевой, нефтеперерабатывающей промышленности, в криминалистике, в сельском хозяйстве, в клиническом анализе и научных исследованиях. Особенно важен данный метод для контроля за выбросами токсичных веществ и для мониторинга состояния окружающей среды.
14.Закон Бугера-Ламберта-Бера. Приемы определения неизвестной концентрации: прямые и косвенные (фотометрическое титрование).
Зако́н Бугера — Ламберта — Бера — физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде.
Закон выражается следующей формулой:
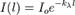 ,где
,где  — интенсивность входящего пучка,
— интенсивность входящего пучка, 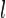 — толщина слоя вещества, через которое проходит свет,
— толщина слоя вещества, через которое проходит свет, 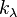 — показатель поглощения (не путать с безразмерным показателем поглощения
— показатель поглощения (не путать с безразмерным показателем поглощения 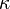 , который связан с
, который связан с 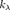 формулой
формулой 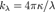 , где
, где 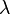 — длина волны).
— длина волны).
Показатель поглощения характеризует свойства вещества и зависит от длины волны λ поглощаемого света. Эта зависимость называется спектром поглощениявещества.
Приёмы определения неизвестной концентрации в инструментальных методах анализа
Для определения неизвестной концентрации вещества по величине АС химики-аналитики используют несколько прямых и косвенных приёмов, общих для всех физических и физико-химических методов анализа.
Прямые приёмы основаны на использовании зависимости I = f(C). Они требуют наличия эталонов, могут быть графическими и расчётными.
Косвенные приёмы (инструментальное титрование) основаны на измерении АС в ходе титрования. Они не требуют наличия эталонов.Кривую титрования строят в координатах «АС – объём титранта».
15.Люминесцентный метод анализа. Теоретические основы метода, его возможности. Качественный и количественный люминесцентный анализ.
Люминесцентный анализ
Принцип метода и области его применения. В определенных условиях часть поглощенной веществом энергии может выделиться в виде вторичного излучения. Это явление называютлюминесценцией. Кванты вторичного излучения, испускаемого люминесцирующими атомами, молекулами или ионами, имеют меньшую энергию, чем кванты, которые те же частицы поглощали при своем возбуждении. Виды люминесценции классифицируют по способу возбуждения. Наиболее известны:
1. Катодолюминесценция (свечение под действием потока электронов, например, свечение экрана кинескопа или жидкокристаллического экрана, свечение ламп дневного света).
2. Хемилюминесценция (свечение за счет химической реакции, например, у светлячков).
3. Фотолюминесценция. В этом случае проба светится за счет облучения невидимым УФ-светом от внешнего источника. Именно этот вид люминесценции обычно применяют в химическом анализе.
Виды люминесценции классифицируют и по времени жизни возбужденного состояния. В анализе преимущественно используют флуоресценцию – в этом случае возбужденное состояние молекулы неустойчиво, и вторичное излучение пробы в УФ- или видимой области спектра прекращается сразу после удаления источника возбуждения. Иногда используют и фосфоресценцию – в этом случае свечение вещества продолжается в течение нескольких секунд, минут или даже часов после прекращения возбуждения. Явление люминесценции известно с давних времен, но физики стали изучать его лишь во второй половине XIX века. В 1864 г. Дж. Стокс (Англия) установил связь интенсивности свечения с концентрацией флуоресцирующих веществ в растворе и предложил использовать такую связь в аналитических целях, подчеркнув высокую чувствительность нового метода. В настоящее время в качестве аналитического сигнала используют интенсивность вторичного излучения на некоторой длине волны.
Первые методики люминесцентного анализа были созданы в 30-х годах XX века, во многом благодаря работам академика С.И.Вавилова и его учеников. Сегодня этот метод используют не очень широко, но в некоторых областях он просто незаменим. По спектрам люминесценции опознают особо опасные органические вещества в объектах окружающей среды (на уровне 10-6 % и ниже). В частности, такнаходят содержание полициклических ароматических углеводородов (ПАУ), многие из которых являются канцерогенами. Эти вещества определяют в природных и сточных водах, воздухе, почвах, продуктах питания. Тот же метод используют для обнаружения других токсикантов (диоксины, нитрозамины, пестициды), а также многих биологически активных веществ (витамины, гормоны, антибиотики). Люминесцентные детекторы применяют в хроматографическом анализе, измеряя интенсивность свечения веществ, по очереди выходящих из хроматографической колонки. Люминесцентный анализ применяют в криминалистической экспертизе и для диагностики заболеваний.
Люминесцировать могут далеко не все молекулы, поглощающие свет. Большая часть органических веществ, способных люминесцировать, – это ароматические соединения, имеющие жесткую структуру молекулы.
Так, фенолфталеин и флуоресцеин имеют сходное строение молекул (см. схему). Но у фенолфталеина все три бензольных кольца могут свободно колебаться друг относительно друга, и это соединение не люминесцирует. У флуоресцеина же возможность внутримолекулярных колебаний гораздо меньше (кислородный мостик жестко фиксирует два бензольных кольца), и это соединение интенсивно светится в видимой области при облучении его раствора УФ-светом.
Качественный люминесцентный анализ. По появлению люминесценции при УФ-облучении пробы, а также по характерному цвету люминесценции можно визуально опознавать некоторые элементы, например, уран, находящийся в растворе в виде ионов. Известен целый ряд качественных реакций, приводящих к образованию люминесцирующих соединений. Так, например, можно открывать (а затем и определять) субмикрограммовые количества ионов кадмия по реакции с кальцеином, ионы бериллия и циркония – по реакции с морином, ионы цинка – с салициловой кислотой, ионы алюминия - с 8-оксихинолином.
По характерному цвету люминесценции выявляют и присутствие некоторых органических соединений. Например, полиароматические углеводороды (ПАУ) дают синее свечение, а смолы и асфальтены – сине-зеленое. В этих случаях люминесценцию наблюдают визуально, облучая анализируемый образец ультрафиолетовым светом ртутной лампы. Нелюминесцирующие соединения при этом не мешают. Чтобы выявить присутствие одного люминесцирующего соединения в присутствии другого, придется снимать спектр возбуждения или испускания исследуемой пробы и сопоставлять их с атласом соответствующих спектров. Но спектры люминесценции структурно-родственных соединений (например, спектры разных ПАУ) весьма близки. Идентифицировать индивидуальные соединения в их неразделенной смеси по обычным (широкополосным) спектрам люминесценции удается крайне редко, спектры разных веществ накладываются друг на друга.
Аналитические возможности люминесцентного анализа существенно расширило одно открытие советских физиков. В 1952 г. было установлено, что спектры люминесценции разбавленных и замороженных растворов ароматических соединений существенно отличаются от обычных. Спектр замороженного раствора будет состоять из большого числа очень узких полос, больше похожих на линии. Такие спектры называются квазилинейчатыми. Для их получения надо специально подбирать растворитель и очень сильно охлаждать раствор - до температуры жидкого азота (-196 С0). Данный эффект носит название эффект Шпольского (рис.7). По квазилинейчатым спектрам можно идентифицировать ПАУ даже в многокомпонентных смесях.
16.Нефелометрия и турбидиметрия: сущность методов, их возможности. Основные узлы и общий принцип работы приборов. Закон Рэлея. Приемы определения неизвестной концентрации.
Принцип метода основан на измерении интенсивности света определённой длины волны, прошедшего через кювету содержащую коллоидный раствор, чаще всего через суспензию, образованную частицами определяемого вещества.
Метод очень похож на метод нефелометрии, однако в отличие от него, аналитическим сигналом служит интенсивность не рассеянного света, а прошедшего.
Для турбидиметрических измерений можно использовать любой фотометр или спектрофотометр.
Турбидиметрия- метод исследования, основанный на измерении интенсивности света, прошедшего через дисперсную систему. Интенсивность падающего светового потока ослабляется в результате его рассеяния дисперсной системой. Преимущество турбидиметрического метода исследования состоит в простоте методики измерений. можно использовать широко распространенные фотоэлектроколориметры, предназначенные для определения оптической плотности окрашенных молекулярных растворов. В основу действия большинства фотоэлектроколориметров положен принцип уравнивания двух сравниваемых световых потоков, проходящих через кюветы с исследуемой и стандартной системами, с помощью переменной щелевой диафрагмы Точность турбидиметрического метода небольшая, поскольку интенсивность рассеяния (относительно малая величина) определяется по разности двух больших значений интенсивностей падающего и проходящего света. Применение метода ограничивается золями, отличающимися сравнительно высокой мутностью
Нефелометрия
- метод исследования, при котором измеряют интенсивность света, рассеянного дисперсной системой. Более высокие чувствительность и точность этого метода, по сравнению с достигаемой в турбидиметрии, позволяют определять не только концентрацию и размер частиц, но и форму частиц, межчастичные взаимодействия и другие свойства дисперсных систем. Эти особенности нефелометрии обусловлены непосредственным измерением интенсивности рассеянного света, значения которой малы (при сравнивании с интенсивностью падающего и проходящего света) .
Закон Рэлея — Джинса — закон излучения для равновесной плотности излучения 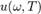 и для испускательной способности
и для испускательной способности 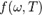 абсолютно чёрного тела, который получили Рэлей и Джинс в рамках классической статистики (теорема о равнораспределении энергии по степеням свободы и представление об электромагнитном поле как о бесконечномерной динамической системе)
абсолютно чёрного тела, который получили Рэлей и Джинс в рамках классической статистики (теорема о равнораспределении энергии по степеням свободы и представление об электромагнитном поле как о бесконечномерной динамической системе)
Правильно описывал низкочастотную часть спектра, при средних частотах приводил к резкому расхождению с экспериментом, а при высоких — к абсурдному результату (см. ниже), означавшему неудовлетворительность классической физики
Вывод основывается на законе о равнораспределении энергии по степеням свободы: на каждое электромагнитное колебание приходится в среднем энергия, складываемая из двух частей 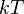 . Одну половинку вносит электрическая составляющая волны, а вторую — магнитная. Само по себе, равновесное излучение в полости, можно представить как систему стоячих волн. Количество стоячих волн в трехмерном пространстве дается выражением:
. Одну половинку вносит электрическая составляющая волны, а вторую — магнитная. Само по себе, равновесное излучение в полости, можно представить как систему стоячих волн. Количество стоячих волн в трехмерном пространстве дается выражением:
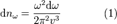 .
. 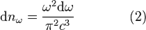
В нашем случае скорость 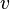 следует положить равной
следует положить равной  , более того, в одном направлении могут двигаться две электромагнитные волны с одной частотой, но со взаимно перпендикулярными поляризациями, тогда (1) вдобавок следует помножить на два:
, более того, в одном направлении могут двигаться две электромагнитные волны с одной частотой, но со взаимно перпендикулярными поляризациями, тогда (1) вдобавок следует помножить на два:
Рэлей и Джинс каждому колебанию приписали энергию 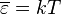 . Помножив (2) на
. Помножив (2) на 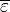 , получим плотность энергии, которая приходится на интервал частот
, получим плотность энергии, которая приходится на интервал частот 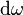 :
:
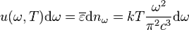 ,тогда:
,тогда: 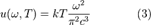 .
.
Зная связь испускательной способности абсолютно чёрного тела 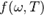 с равновесной плотностью энергии теплового излучения
с равновесной плотностью энергии теплового излучения 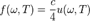 , для
, для 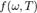 находим:
находим: 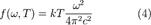 .
.
Выражения (3) и (4) называют формулой Рэлея — Джинса.
21. Ионный обмен: сущность и механизм ионного обмена, применение в анализе. Иониты. Ионообменное равновесие. Обменная емкость Ионный обмен — это обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом (ионитом) и раствором электролита. Ионный обмен может происходить как в гомогенной среде (истинный раствор нескольких электролитов), так и в гетерогенной, в которой один из электролитов является твёрдым (при контакте раствора электролита с осадком, ионитом и др.).
Ионный обмен основан на использовании ионитов — сетчатых полимеров разной степени сшивки, гелевой микро- или макропористой структуры, ковалентно связанных с ионогенными группами. Обменивающиеся ионы называются противоионами. Иониты состоят из неподвижного каркаса — матрицы и функциональных групп — фиксированных ионов, которые жестко прикреплены к матрице и взаимодействуют с противоионами. В зависимости от знака заряда противоионов иониты делят на катиониты и аниониты. Если противоионы заряжены положительно, то они являются катионами (например, ионы водорода Н+ или ионы металлов), ионит называют катионитом. Если противоионы заряжены отрицательно, то есть являются анионами (например, ион гидроксила ОН- или кислотные остатки), ионит называют анионитом.
ИОНИТЫ (ионообменники, ионообменные сорбенты), полимерные в-ва и материалы, содержащие ионогенные и (или) комплексообразующие группы, способные к обмену ионов при контакте с р-рами электролитов. Большинство ионитов - твердые нерастворимые полиэлектролиты аморфной или кристаллич. структуры
ИОНООБМЕННОЕ РАВНОВЕСИЕ -
Принцип ионного обмена и терминология. При контакте с растворами электролитов некоторые твердые вещества способны обмениваться ионами с раствором. Для осуществления ионного обмена необходимо, чтобы среда обеспечивала диссоциацию растворенных веществ. Способность к обмену ионов обнаружена у очень многих природных неорганических и органических веществ. Их изучение послужило основой для синтеза веществ, обладающих ионообменными свойствами.
17. Рефрактометрия: сущность метода, его возможности. Измерение аналитического сигнала: основные узлы и общий принцип работы приборов. Удельная и молярная рефракция. Формула Лоренца-Лорентца.
Рефрактометрия (от лат. refractus — преломленный и др.-греч. μετρέω «измеряю») — это метод исследования веществ, основанный на определении показателя (коэффициента) преломления (рефракции) и некоторых его функций. Рефрактометрия (рефрактометрический метод) применяется для идентификации химических соединений, количественного и структурного анализа, определения физико-химических параметров веществ. Относительный показатель преломления n представляет собой отношение скоростей света в граничащих средах. Для жидкостей и твердых тел n обычно определяют относительно воздуха, а для газов — относительно вакуума (абсолютный показатель преломления). Значения n зависят от длины волны λ света и температуры, которые указывают соответственно в подстрочном и надстрочном индексах. Например, показатель преломления при 20 °C для D-линии спектра натрия (λ = 589 нм) — 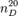 . Часто используют также линии спектра водорода Н (λ = 656 нм) и F (λ = 486 нм). В случае газов необходимо также учитывать зависимость n от давления (указывать его или приводить данные к нормальному давлению).
. Часто используют также линии спектра водорода Н (λ = 656 нм) и F (λ = 486 нм). В случае газов необходимо также учитывать зависимость n от давления (указывать его или приводить данные к нормальному давлению).
В идеальных системах (образующихся без изменения объема и поляризуемости компонентов) зависимость показателя преломления от состава близка к линейной, если состав выражен в объёмных долях (процентах) n=n1V1+n2V2 ,где n, n1 ,n2 — показатели преломления смеси и компонентов, V1 и V2 — объемные доли компонентов (V1 + V2 = 1).Для рефрактометрии растворов в широких диапазонах концентраций пользуются таблицами или эмпирическими формулами, важнейшие из которых (для растворов сахарозы, этанола и др.) утверждаются международными соглашениями и лежат в основе построения шкал специализированных рефрактометров для анализа промышленной и сельскохозяйственной продукции.
УДЕЛЬНАЯ РЕФРАКЦИЯ
(r )-характеризует электронную поляризуемость единицы массы вещества в высокочастотном эл.-магн. полесветовой волны. У. р. вещества равна его молекулярной рефракции R, делённой на молекулярную массу M.У. р. может быть выражена через показатель преломления n вещества неск. способами; чаще всего еёзаписывают в виде
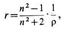 где r - плотность вещества.
где r - плотность вещества.
МОЛЕКУЛЯРНАЯ РЕФРАКЦИЯ
(R) - связывает электронную поляризуемость a эл вещества (см. Поляризуемость атомов, ионов и молекул) сего прелом. <ле-ния показателем п. В пределах применимости выражений для M. р. она, характеризуя, каки п, способность вещества преломлять свет, отличается от n тем, что практически не зависит от плотности,темп-ры и агрегатного состояния вещества.
Осн. ф-ла M. р. имеет вид
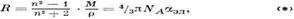 где M - молекулярная масса вещества, r - его плотность, NA - Авогадро постоянная. Ф-ла (*) является эквивалентом ЛоренцаЛоренца формулы (с теми же ограничениями на применимость), но во мн. случаяхболее удобна для практич. приложений. Часто M. р. можно представить как сумму "рефракций" атомов илигрупп атомов, составляющих молекулу сложного вещества, или их связей в такой молекуле. Напр., M. р.предельного углеводорода CkH2k+2 равна kRC+ + (2k + 2)R Н (k=1,2,...). Это важное свойство M. р. -аддитивность - позволяет успешно применять рефрактометрич. методы для исследования структурысоединений, определения дипольных моментов молекул, изучения водородных связей, определения составасмесей и для др. физ.-хим. задач.
где M - молекулярная масса вещества, r - его плотность, NA - Авогадро постоянная. Ф-ла (*) является эквивалентом ЛоренцаЛоренца формулы (с теми же ограничениями на применимость), но во мн. случаяхболее удобна для практич. приложений. Часто M. р. можно представить как сумму "рефракций" атомов илигрупп атомов, составляющих молекулу сложного вещества, или их связей в такой молекуле. Напр., M. р.предельного углеводорода CkH2k+2 равна kRC+ + (2k + 2)R Н (k=1,2,...). Это важное свойство M. р. -аддитивность - позволяет успешно применять рефрактометрич. методы для исследования структурысоединений, определения дипольных моментов молекул, изучения водородных связей, определения составасмесей и для др. физ.-хим. задач.
Фо́рмула Ло́ренца — Ло́ренца связывает показатель преломления вещества с электронной поляризуемостью частиц (атомов, ионов, молекул), из которых оно состоит. Формулу получили датский физик Людвиг В. Лоренц (дат. Ludvig Valentin Lorenz ) и голландский физик Хендрик А. Лоренц (нидерл.
Hendrik Antoon Lorentz) в 1880 году независимо друг от друга[1].Если вещество состоит из частиц одного сорта, то формула имеет вид: где
где 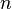 — показатель преломления,
— показатель преломления, 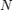 — количество частиц в единице объёма, а
— количество частиц в единице объёма, а 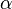 — их поляризуемость. Уточним, что под поляризуемостью частицы здесь понимается коэффициент
— их поляризуемость. Уточним, что под поляризуемостью частицы здесь понимается коэффициент 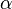 , связывающий напряжённость электрического поля
, связывающий напряжённость электрического поля 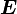 , действующего на частицу, сдипольным моментом
, действующего на частицу, сдипольным моментом
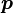 , образующимся у частицы под действием этого поля[2]:
, образующимся у частицы под действием этого поля[2]: 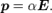 Здесь и далее жирным шрифтом выделяются векторные величины. Формулу записывают также в виде:
Здесь и далее жирным шрифтом выделяются векторные величины. Формулу записывают также в виде:
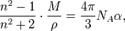 где
где 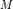 — молекулярная масса вещества,
— молекулярная масса вещества, 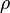 — его плотность, а
— его плотность, а 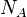 — постоянная Авогадро. При этом величину
— постоянная Авогадро. При этом величину 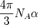 называют молекулярной рефракцией.Если вещество состоит из частиц нескольких сортов с поляризуемостями
называют молекулярной рефракцией.Если вещество состоит из частиц нескольких сортов с поляризуемостями 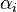 и объёмными концентрациями
и объёмными концентрациями 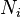 , то формула принимает вид:
, то формула принимает вид:
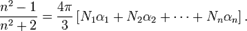
Вывод формулы основан на рассмотрении микроскопического поля и его взаимодействия с атомами, молекулами и ионами вещества. При выводе предполагается, что среда является изотропной, а составляющие её частицы собственным дипольным моментом не обладают[3].
20. Сорбционные методы: сущность и применение в анализе, классификация по механизму взаимодействия с сорбентом.Сорбцию хорошо используют для разделения и концентрирования веществ. Сорбционные методы обычно обеспечивают хорошую селективность разделения, высокие значения коэффициентов концентрирования.Сорбция – процесс поглощения газов, паров и растворенных веществ твердыми или жидкими поглотителями на твердом носителе (сорбентами).
