Потенциометрическое титрование
Принцип метода: зависимость равновесного потенциала индикаторного электрода от состава раствора, описываемого уравнением Нернста, можно использовать для нахождения конечной точки титрования.
При измерении в анализируемый раствор помещают индикаторный электрод (например, стеклянный) и электрод сравнения с постоянным потенциалом (например, каломельный), которые образуют гальваническую пару. К раствору добавляют титрант маленькими порциями (по 0,1-0,2 мл). Зависимость измеренной ЭДС от объема титранта изображают графически. Для получения кривой титрования по оси ординат откладывают величину ЭДС, а по оси абсцисс – число миллилитров раствора титранта. Начальный участок кривой потенциометрического титрования (рис. 14) (~ 90% всего титранта) характеризуется медленным изменением электродного потенциала. В точке эквивалентности наблюдается резкий скачок электродного потенциала и далее темп его изменения замедляется. Точность нахождения конечной точки можно повысить путем дифференцирования кривой титрования.
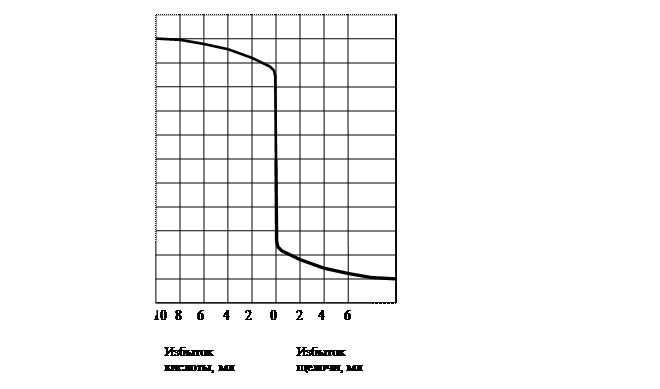
Рис. 14. Кривая титрования 0,1 М раствора хлороводородной кислоты 0,1 М раствором гидроксида натрия
Эквивалентная точка находится в середине вертикального отрезка кривой.
Потенциометрическое титрование имеет преимущество по сравнению с титрованием в присутствии индикаторов в том случае, когда растворы интенсивно окрашены или в растворе меняются ионы, образующие осадки с вводимыми реактивами или легко меняющие свою степень окисления (окисляемые). Кроме того, этот метод допускает титрование до любого желаемого значения pH.
Из кривых потенциометрического титрования можно экспериментально определять константы равновесий различных реакций, константы диссоциации, произведения растворимости.
Метод потенциометрического титрования используется в контроле хронологических процессов, анализе биологических объектов, при геологических изысканиях, в контроле качества воды.
| |
Опыт 1. Потенциометрическое кислотно-основное титрование.
Оборудование: потенциометр (рН-метр); каломельный или хлорсеребряный электроды сравнения; стеклянный индикаторный электрод; химические стаканы на 100-150 мл; бюретки на 25-50 мл с делениями в 0,1 мл; пипетки на 20-25 мл; резиновые груши; магнитные мешалки.
Реактивы: анализируемый раствор HCl (~1М) и 1 М стандартный раствор NaOH.
Ход работы
Проводят процедуру согласования потенциометра (рН-метра) в соответствие с инструкцией к прибору.
В стакан на 100-150 мл наливают пипеткой 20-25 мл раствора HCl неизвестной концентрации и опускают в него электроды (сравнения и индикаторный), предварительно промытые дистиллированной водой и осушенные фильтровальной бумагой. Перемешивание раствора ведут с помощью магнитной мешалки. Несколько минут дают адаптироваться электродам к анализируемому раствору.
Бюретку, наполненную раствором щелочи известной концентрации, устанавливают над стаканом с титруемым раствором кислоты и измеряют начальное значение ЭДС (напряжение ячейки) с помощью pH-метра.
Из бюретки добавляют к раствору кислоты последовательно по 1 мл раствора щелочи и записывают показания прибора. Когда электродвижущая сила станет резко изменяться, начинают приливать по 0,1 мл раствора щелочи, а затем, когда ЭДС элемента станет изменяться незначительно, 4-5 раз приливают по 1 мл титранта. Каждый раз после добавления раствора щелочи записывают показания pH-метра.
По окончании работы выключают прибор, вынимают электроды из раствора, промывают их дистиллированной водой и обсушивают фильтровальной бумагой или помещают в стакан с дистиллированной водой для хранения.
По полученным данным строят график, откладывая на оси абсцисс количество миллилитров раствора щелочи, а на оси ординат – величину ЭДС напряжения ячейки. По графику находят точку эквивалентности и вычисляют концентрацию кислоты.
Опыт 2. Определение хлороводородной и борной кислот в их смеси методом потенциометрического титрования.
Борную кислоту H3BO3 в водном растворе титровать нельзя, так как константа диссоциации ее мала (рКа1 = 9,24). Однако в присутствии некоторых органических веществ (маннита, глицерина) свойства борной кислоты усиливаются за счет образования более сильной кислоты (например, бороманнитовой или бороглицериновой). Сначала смесь титруют без добавления маннита (глицерина), при этом титруется только сильная хлороводородная кислота. После этого добавляют в раствор маннит или глицерин и титруют H3BO3 как одноосновную кислоту. Измеряют рН раствора.
Оборудование: рН-метр; каломельный или хлорсеребряный электроды сравнения; стеклянный индикаторный электрод; магнитные мешалки; мерные колбы на 100 мл; химические стаканы на 100-150 мл; бюретки на 25-50 мл с делениями в 0,1 мл; пипетки на 20-25 мл; груши резиновые.
Реактивы: анализируемый раствор – смесь ~ 0,1 М растворов HCl и H3BO3; маннит или глицерин; стандартный 0,1 М раствор NaOH.
Ход работы
Проводят процедуру согласования рН-метра в соответствие с инструкцией к прибору.
Анализируемый раствор (произвольное количество от 20 до 50 мл) смеси кислот в мерной колбе на 100 мл разбавляют до метки дистиллированной водой. Переносят пипеткой 20 мл в стакан для титрования и добавляют дистиллированную воду так, чтобы электроды (сравнения и индикаторный) были погружены в раствор. Перемешивают раствор с помощью магнитной мешалки. Несколько минут дают адаптироваться электродам к анализируемому раствору.
Бюретку, наполненную раствором щелочи известной концентрации, устанавливают над стаканом с титруемым раствором смеси кислот. Смесь титруют раствором NaOH, прибавляя его из микробюретки по 0,2 мл. Записывают показания рН-метра и объем NaOH. По резкому изменению значения рН определяют первый скачок потенциала, соответствующий точке эквивалентности титрования хлороводородной кислоты. Затем прибавляют 10 мл глицерина (или маннита) и продолжают титрование до обнаружения второго скачка потенциала. Для получения более точных результатов проводят повторное определение.
Строят две кривые: одну в координатах рН - VNaOH, другую ΔрН/ΔV - VNaOH. По графикам находят V1 – объем раствора NaOH (мл), израсходованного на титрование HCl и V2 – объем раствора NaOH (мл), израсходованного на титрование H3BO3. Рассчитывают концентрации HCl и H3BO3 в анализируемом растворе.
