Качественный анализ. Важнейшие аналитические реакции ионов
221 - 250.Закончите аналитическую реакцию с указанием аналитического сигнала, условия проведения реакции (рН среды, температура, мешающее влияние других ионов), способ проведения реакции. Привести ионное, ионно-сокоащенные уравнения:
221.NH4Cl + NaOH →
NH4Cl + K2[HgI4] + KOH →
222.MgCl2 + Na2HPO4 + NH4OH →
MgNH4PO4 + CH3COOH →
223. CaCl2 + Н2SO4 →
CaCl2 + Na2SO4 + H2O →
CaCl2 + K4[Fe(CN)6] →
224.BaCl2 + K2CrO4 →
BaCl2 + K2Cr2O7 + … + H2O →
225.Mn(NO3)2 + PbO2 + HNO3 →
MnCl2 + H2O2 + NaOH →
226. MnCl2 + NaBiO3 + HNO3 →
Мn(ОH)2 + O2 →
227.FeCl2 + K3[Fe(CN)6] →;
Fе(ОН)2 + О2 + Н2O →
228.FeCl3 + NH4CNS →
FeCl3 + K4[Fe(CN)6] →
229.Fe(CNS)3 + K4[Fe(CN)6] →
Al3+ + NH3 + H2O →
230.Zn2+ + NH3 + H2O →
Zn(OH)2 ¯ + 4 NH3 →
231. Pb(NO3)2 + K2Cr2O7 + H2O →
AgCl ¯ + 2 NH3 →
232.Na2HPO4 + (NH4)2MoO4 + HNO3 → (NH4)3 Н4[PMo12O42]↓ + ….,
233.Na3PO4 + MgCl2 + NH4Cl →
Na2SO3 + HCl →
234. I2 + SO2 + H2O →
Na2SO3 + I2 + H2O →
235.Na2S2O3 + HCl → S¯ + ..
HBr + H2SO4 →
236.KI + H2SO4 →
NaNO3 + FeSO4 + H2SO4 →
237.NO + FeSO4 →
NaNO2 + KI + CH3COOH → .
238. NaNO2 + KMnO4 + HNO3 →.
239.K2Cr2O7 + KI + H2SO4 →
240.KMnO4 + FeSO4 + H2SO4 →
241.KCl + Na3[Cо(NO2)6] →
MgCl2 + Na2CO3 + H2O →
242.Al2(SO4)3 + (NH4)2S + H2O →
Na2CO3 + AlCl3 + H2O →
243.Al(CH3COO)3 + H2O →
AlCl3 + Na2HPO4 →
244.Zn(OH)2 + 2NaOH →
ZnCl2 + 2NH4OH →
245.BaCl2 + Na2HPO4 →
Na2HPO4 + NH4OH + BaCl2 →
246.Na2HPO4 + MgCl2 + NH4OH →
(NH4)2CO3 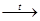
(NH4)3PO4 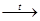
(NH4)2CO3 + H2O 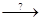
247.CaCl2 + NH4Cl + K4[Fe(CN)6] →
(NH4)2S + H2O →
248.FeCl3 + NH4SCN → [FeSCN]2+ + …
ZnCl2 + … + H2S →
249. AlCl3 + Na3CO3 + H2O →
Al(CH3COO)3 + H2O →
250.H2C2O4 + KMnO4 + KOH →
H2C2O4 + KMnO4 + H2O →
Основные понятия и термины качественного анализа. Основы метода.
251. Аналитические реакции, аналитический сигнал. Требования, предъявляемые к аналитическим реакциям. Чувствительность химических реакций: открываемый минимум, предельная концентрация, предельное разбавление, показатель чувствительности.
252.Химические реагенты и их классификация по степени чистоты. Способы выполнения аналитических реакций. Примеры.
253.Химические реагенты: общие, групповые, характерные (селективные и специфические). Примеры. Реагент, групповой реагент. Требования к ним. Примеры применения групповых реагентов в анализе катионов и анионов.
254.Способы выполнения реакций “мокрым” путем: пробирочный, микрокристаллоскопический, хроматографический, экстракционный и в “газовой камере”.
255.Химический анализ и его классификация ( по объектам анализа, по массе или объёму образца, взятого на анализ).
256.Методы химического анализа и их классификация по аналитическому сигналу реакции.
257. Дробный анализ. Написать примеры уравнения реакций дробного обнаружения катионов.
259.Дробный анализ. Написать примеры уравнения реакций дробного обнаружения анионов.
260. Систематический анализ. Написать примеры уравнения реакций систематического хода анализа катионов. (по сероводородной классификации).
261.Органические реагенты и их роль в качественном химическом анализе. Примеры
Основные понятия, приемы количественного анализа.
262.Первичные стандарты и требования к ним. Стандартные (приготовленные) растворы и их использование в титриметрии. Приведите примеры таких веществ и растворов.
262.Вторичные стандарты и стандартизованные (установленные) растворы и их использование в титриметрии. Приведите примеры таких веществ и растворов.
263.Классификация методов титриметрического анализа по типу химических реакций, лежащих в их основе, напишите основные уравнения методов
264.На конкретных примерах поясните сущность основных вариантов (приёмов) титрования: прямое, обратное, по заместителю. Условия их применения
265.Титриметрический метод анализа и его основной приём. Достоинства и недостатки метода.
266.Титранты (титрованные растворы), все способы выражения их концентрации.
267.. Основные требования к реакциям, применяемым в титриметрическом анализе
268.Закон эквивалентов и его следствие применительно к титриметрическим методам анализа. Приведите их математические выражения.
269.Точка эквивалентности (теоретическая), способы обнаружения конечной точки (точки эквивалентности). Точка конца титрования, связь между ними.
270.. Обосновать принципы выбора индикатора в методе кислотно-основного титрования.
271.Способы фиксирования конечной точки титрования. Понятие о химических индикаторах.
272.Классификация индикаторов в зависимости от типа химической реакции и физико-химических процессов, протекающих в конечной точке титрования.
273.Металлоиндикаторы: специфические и металлохромные. Требования к металлохромным индикаторам..
274.Точная мерная посуда и её использование в титриметрии.
275.Способы приготовления титрантов (по точной навеске, разбавлением концентрированных растворов, из фиксаналов).
276.Кривые титрования в методе кислотно-основного титрования. Их значение при выборе индикатора.
277.Окислительно-восстановительные индикаторы, их свойства. Примеры использования в редокс-методах.
278.Определение понятия «титрованный раствор», способы выражения его концентрации: молярная концентрация, молярная концентрация эквивалента, титр раствора по рабочему веществу, титр раствора по определяемому веществу.
279.Теории индикаторов (ионная, хромофорная, ионно-хромофорная).
280. Выбор кислотно-основных индикаторов. Равновесия в растворах индикаторов. Константа диссоциации индикаторов, интервал перехода окраски.
281.Жесткость воды, ее виды. Методы устранения (приведите уравнения соответствующих реакций).
282. Комплексоны, трилон Б (формула). Приведите соответствующие примеры применения и уравнения реакций.
