Антитела: структура и свойства
Так как, основным компонентом ИФА являются антитела необходимо более подробно познакомиться со структурой и свойствами этих веществ.
Антитела появляются в сыворотке иммунизированного человека или животного в результате специфической реакции организма на введение в него антигенов. Антитела могут находиться не только в крови, но и в тканевой жидкости. Благодаря своей идентичности исходным антигенраспознающим рецепторам B-клеток они взаимодействуют с тем антигеном, который первоначально активировал B-клетки, проявляя, таким образом, строгую специфичность. В организме антитела выполняют две основные функции:
- распознавание и специфическое связывание антигена;
- индукция важнейших физиологических процессов, направленных на уничтожение антигена.
Антитела или иммуноглобулины в химическом отношении являются гликопротеидами, состоящими из аминокислот и олигосахаридов. По своим эффекторным свойствам и структурным особенностям иммуноглобулины подразделяются на пять основных классов: IgA, IgD, IgG, IgМ, IgE (рис. 1). При этом, все антитела имеют общий план строения. Молекула иммуноглобулина состоит из двух одинаковых тяжелых (Н-цепь) и двух одинаковых легких (L-цепь) полипептидных цепей. Наличие дисульфидных связей в молекуле обеспечивает прочное соединение легких цепей с NH2-концевыми участками тяжелых цепей и взаимодействие свободных участков тяжелых цепей между собой. В целом структура такого комплекса схожа с латинской буквой “Y” и характерна для иммуноглобулинов классов IgD, IgG, IgМ (рис2).
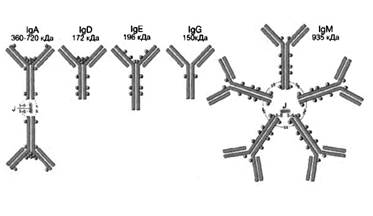
Рисунок 1. Классы антител
При действии на молекулу IgG протеолитического фермента папаина образуется три фрагмента. Два идентичных фрагмента, за способность связывать антиген получивших название Fab-фрагмент (от английского fragment antigen binding), и третий, за способность к кристаллизации названный Fc-фрагмент (от английского fragment cristalline).
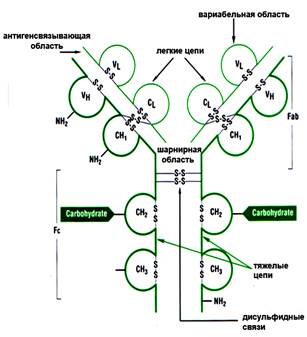
Рисунок 2. Строение молекулы антитела
Fab-фрагмент молекулы антитела ответственен за специфическое распознавание антигена, Fc-фрагмент ответственен за биологические функции антител – связывание с компонентами системы комплимента, взаимодействие с мембранными рецепторами и т.д.
Структурной особенностью, как легких, так и тяжелых цепей является наличие в их составе различных областей (доменов) – вариабельной (V) и константной (С). Легкие цепи образуют по два домена ( VL-домен и CL-домен), тяжелые - четыре или пять в зависимости от класса Ig (один VH-домен и три или четыре CH-домена, соответственно).
Специфичность антител определяется изменениями в последовательности аминокислотных остатков VH-домена и VL-домена цепей иммуноглобулина, взаимодействие между которыми формирует антигенсвязывающие участки этой молекулы. В аминокислотной последовательности V-области любой легкой или тяжелой цепи имеются положения, характеризующиеся частой заменой аминокислот – гипервариабельные участки.
Гетерогенность аминокислот в гипервариабельных последовательностях, как легких, так и тяжелых цепей обеспечивает огромное разнообразие специфических антител благодаря тому, что форма и размер поверхности, образуемой каждой гипервариабельной последовательностью, различны.
Антитела распознают не отдельные химические группы, а пространственную форму антигенов. Методом рентгеноструктурного анализа V-домена было установлено, что каркасные участки Fab-фрагмента молекул антител, обычно не принимающие участие в связывании антигена, имеют существенное значение для укладки домена, которая обеспечивает адекватную конформацию (комплементарность) антигенсвязывающего центра антитела (паратопа) с антигенной детерминантой (эпитопом). А множество нековалентных связей с антигеном образуют отдельные аминокислотные остатки гипервариабельных участков, сосредоточенных на концах Fab-ветвей. Эти взаимодействия (водородные связи, электростатические, ван-дер-ваальсовы и гидрофобные) весьма слабы, однако при большом их числе суммарная энергия связывания получается значительной. Именно действием этих сил обусловлена специфичность антител к данному антигену (т.е. способность различать антигены).
В каждой молекуле иммуноглобулина существует, по крайней мере, два идентичных антигенсвязывающих центра. Эта бивалентность позволяет антителам перекрестно связывать антигены с двумя или более антигенными детерминантами, при этом, подвижность плеч молекулы антител позволяет ей связываться одновременно с антигенными детерминантами, находящимися на разных расстояниях. Наличие шарнирной области в тяжелой цепи обеспечивает конформационную гибкость молекулы иммуноглобулина, позволяя обоим антигенсвязывающим центрам, действовать независимо друг от друга при взаимодействии с антигенными детерминантами. Конформационную гибкость молекулы обеспечивает повышенное содержание пролина в шарнирной области тяжелой цепи.
