Общие методы получения иридоидов
Из растительного сырья
Общим во всех известных методах выделения иридоидов является предварительная двух-, трехкратная экстракция (24 часа) растительного материала метиловым (реже этиловым) спиртом при температуре 40-700С. Сконцентрированный метанольный экстракт обычно растворяют в воде очищенной и обезжиривают обработкой диэтиловым эфиром или хлороформом.
Водорастворимую часть наносят на колонку с оксидом алюминия, полиамидом СС или силикагелем L70/230, элюируют водой и водным метанолом 1:1. Обычным является перехроматографирование на том же сорбенте, но с менее полярными элюентами: хлороформом или смесью хлороформ – метанол (95:5, 90:10 или 85:15) [72,74].
Профессору У.С.Тэйлору удалось использованием только метода адсорбционно-распределительной хроматографии дробное разделение суммы различных по природе иридоидов на индивидуальные компоненты. Для этого, водо-растворимую часть метанольного экстракта растения хроматографировали на колонке с силикагелем L70/230 последовательно элюируя смесями: гексан – этилацетат (от 1:1 до 1:9) и этилацетат - метанол (50:1). Для выделения ацилированных иридоидов гексан-этилацетатный экстракт перехроматографировали на колонке с тем же сорбентом, элюируя смесью дихлорметан – метанол - вода 50:3:1. Элюирование смесью дихлорметан – метанол - вода от 30:3:1 до 10:3:1 на колонке с силикагелем L70/230 этилацетат-метанольного (50:1) экстракта дало возможность выделения индивидуальных оксииридоидов [77].
Для более тонкого разделения смеси иридоидов водорастворимую часть предварительно подвергают фракционированию растворителями различной полярности: гексан, дихлорметан, этилацетат и н-бутанол, с последующим хроматографированием на одном из указанных сорбентов либо гель-фильтрацией на сефадексах (чаще всего LH-20).
Оригинальная хроматографическая система была предло-жена в работе [78]. Водный остаток, после обезжиривания эфиром, был нанесен на колонку с сополимером стирола и дивинилбензола и последовательно элюирован водой, 50% водным метанолом, метанолом и ацетоном. Водно-метанольная фракция была перехроматографирована на колонке с силикагелем, для элюирования были использованы системы: (I) EtOAc–MeOH–H2O (4:1:0.1), (II) EtOAc–MeOH–H2O (7:3:0.3) и (III) EtOAc–MeOH–H2O (6:4:1). Максимальное содержание суммы иридоидов было отмечено в I фракции. Их окончательное разделение было проведено на колонке с RP-18 сорбентом и ацетонитрилом в качестве подвижной фазы.
КАРБОНОВЫЕ КИСЛОТЫ
Органические кислоты разных групп одновременно могут быть в составе многих растений. Они находятся в клеточном соке и присутствуют во всех органах, особенно много их в листьях и незрелых плодах.
Наиболее распространены: уксусная (начало «ацетатного» пути биосинтеза многих других соединений), муравьиная, масляная, щавелевая, яблочная, винная, валериановая и изовалериановая, лимонная кислоты.
Наряду с одно-, двух-, трехосновными карбоновыми и оксикислотами, во многих растениях содержатся амино-, ароматические, феноло- и «лишайниковые» кислоты.
Являясь обязательной составной частью растений, они в большем или меньшем количестве извлекаются полярными растворителями и переходят в состав многих фитопрепаратов (настоев, настоек, экстрактов, сиропов, соков, субстанций, извлечений).
Не все кислоты имеют самостоятельное значение как биологически активные вещества, но дополняют или усиливают биоактивность и биодоступность других веществ растений.
Каждая группа кислот легко определяется специфическими качественными реакциями, а каждая кислота может быть идентифицирована либо методом сравнения с веществами-стандартами (БХ, ТСХ), либо по времени (выхода) удерживания методами хромато-масс, ГЖХ, ЖЖХ или ВЭЖХ.
Выделение:
Около 2-3 г измельченного растительного сырья экстраги-руют в колбе при нагревании на водяной бане 30% водным ацетоном или спиртом этиловым в течение 1 часа, фильтруют.
Для качественного анализа используют 1-3 мл извлечения.
Качественный анализ [10,12]:
q В фарфоровой чашке прибавляют 4 мл раствора аммиака и 1 мл 10% раствора натрия фосфорномолибденовокислого в 10% кислоте хлороводородной, появляется синее окрашивание (аскорбиновая кислота).
q Добавляют 1 мл 1% раствора ферроцианида калия и 1 мл железоаммониевых квасцов, появляется темное или синее окрашивание (окси-, ди- и трикарбоновые кислоты).
q Добавляют 1-3 капли бромкрезолового зеленого, появля-ется желтое окрашивание на зеленом фоне (алифатические кислоты).
q В парах йода появляются коричневые или темные пятна (ненасыщенные кислоты).
q Добавляют 1-3 мл 0.03% раствора орто-фенилендиамина в 10% водном растворе кислоты трихлоруксусной, появляется от синего до зеленого окрашивание и флюоресценция (кето-кислоты).
Хроматографический анализ:
Огромное многообразие, входящих в состав растений кислот, затрудняет их хроматографический анализ. В литера-туре описано множество приборных методик, газовой, газо-жидкостной и высокоэффективной жидкостной хроматографии природных карбоновых кислот, однако все они значительно отличаются, как по типу применяемого сорбента, так и по составу подвижной фазы, используемой для разделения и анализа веществ. Общими для всех типов карбоновых кислот растительного происхождения, по-видимому, являются лишь ТСХ хроматографические системы:
- бензол – диоксан – уксусная кислота (90:25:4);
- бензол – метанол – уксусная кислота (90:16:8);
- бензол – пропионовая кислота – вода (2:2:1, верхний слой);
- пропанол-2 – аммиак – вода (8:1:1);
- бензол – уксусная кислота – вода (6:7:3);
- гексан – этилацетат (9:1);
- этилацетат – уксусная кислота – вода (2:1:1).
Установлено, что для получения наиболее достоверной информации о содержании свободных органических кислот в природных объектах оптимальным является газо-хроматогра-фический метод. Свободные органические кислоты определя-ются в этом случае в виде этиловых эфиров. С этой целью к 10 мл спиртового экстракта растения добавляют раствор, содержащий 10 мг внутреннего стандарта (глутаровой кислоты в ацетоне). Пробу упаривают до 1 мл в фарфоровой чашке. Остаток смывают в пробирку 4 мл смеси спирта этилового 96% и кислоты серной концентрированной (6:1), доводят объем раствора до 25 мл водой очищенной, дают отстояться 10-12 часов. Раствор насыщают хлористым натрием, добавляют 2 мл этилацетата, перемешивают. Отстоявшийся экстракт отделяют и подсушивают небольшим количеством безводного натрия сульфата. Подготовленный таким образом этилацетат-ный экстракт вводят в испаритель хроматографа. Условия хроматографирования:
§ колонка HP INNOWAX (30 м x 0.32 м x 0.25 мкм)
§ температура от 35до 2300C со скоростью 100C/мин
§ газ-носитель – гелий
§ пламенно-ионизационный детектор [79].
Анализ может быть осуществлен как для свободных насыщенных или ненасыщенных жирных кислот, так и для их метиловых эфиров. Анализ чаще всего проводится на капилляр-ных колонках Stabilwax-DA или Carbowax при температуре 100-1450С с использованием гелия или водорода в качестве газа-носителя.
Жирно-кислотный состав растения также может быть установлен методом газожидкостной хроматографии в виде метиловых эфиров на хроматографе с пламенно-ионизационным детектором с использованием насадочной колонки, заполненной хроматоном N-AW-DS c нанесенной жидкой фазой – диэтиленгликольсукцинатом (DEgS) 20% [80].
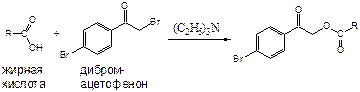 |
Способ ВЭЖХ исследования жирных кислот заключается в предварительной обработке экстракта 0.3 M раствором дибромацетофенона и дальнейшем анализе производных на колонке Phenomenex Prodigy C8, с использованием подвижной
фазы: ацетонитрил – вода 87:13 или 1:1 и УФ детектора (242 нм) либо флуориметра.
Другим вариантом ВЭЖХ анализа производных жирных кислот может быть обращенно-фазное разделение на колонке Ultrasphere C18 с градиентом подвижной фазы: дихлорметан-метанол от 1:9 до 7:3 за 25 мин. и УФ детектором (260 нм) [81].
Разделение и анализ феноло-, оксикоричных и лишайниковых кислот целесообразно проводить в системе: колонка Aqua ODS C18, подвижная фаза А: 2% уксусная кислота, В: 0.5% уксусная кислота-ацетонитрил (1:1) с градиентным элюированием от 10:55 до 55:100 за 50 минут. Лишайниковые и фенолокислоты определяют при 280 нм, оксикоричные кислоты – при 320 нм [82]. Предложен метод анализа феноло- и оксикоричных кислот на колонке с LiСhrospher RP-C18 с использованием подвижной фазы: 0.1% трифторуксусная кислота – ацетонитрил с увеличением содержания последнего в смеси от 10 до 100% за 45 мин и фотодиодного детектора [83]. Высокую селективность в исследовании феноло- и оксикоричных кислот показала система: колонка - LiChrosorb RP-C18, с линейным градиентом подвижной фазы метанол-уксусная кислота-вода от (10:2:88) до (90:2:8) за 30 минут и УФ детектировании при 276 нм [84].
Количественное определение карбоновых кислот осуществляют чаще всего методом титрования. Этот метод дает завышенные результаты за счет других сопутствующих веществ кислого характера.
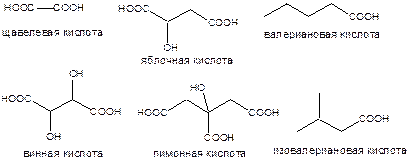
Кислоты свободные органические.
10 г (точная навеска) измельченного сырья помещают в колбу вместимостью 100 мл, прибавляют 80 мл воды очищенной и выдерживают на кипящей водяной бане в течение 2 часов, затем охлаждают и фильтруют в мерную колбу вместимостью 100 мл, доводят объем извлечения водой очищенной до метки, перемешивают.
10 мл полученного раствора помещают в колбу вместимостью 100 мл, прибавляют 1 мл 1% спиртового раствора фенолфталеина и титруют 0.1М раствором натрия гидроксида до появления бледно-розового окрашивания. (*)
Содержание свободных органических кислот в абсолютно сухом сырье в процентах вычисляют по формуле:
|
m . 10 . (100 - W)
где V – объем 0.1М раствора натрия гидроксида, пошедшего на титрование в миллилитрах;
m – масса навески сырья, в граммах;
W – потеря в массе при высушивании сырья, в процентах;
Р = 0.0067 г яблочной кислоты, соответствующее 1 мл 0.1М раствора натрия гидроксида.
* Индикатором может быть смесь из 1 мл 1% спиртового раствора фенолфталеина и 2 мл 0.1% раствора метиленового синего; титрование проводят до появления лилово-красного окрашивания.
** К аликвоте испытуемого раствора прибавляют 1 мл 2% кислоты хлороводородной и титруют 0.001М раствором 2,6-дихлорфенолиндофенолята натрия до появления розового окрашивания. 1 мл 0.001М раствора 2,6-дихлорфенолиндо-фенолята натрия = 0.000088 г кислоты аскорбиновой [7].
Примечания. Приготовление 0.001М раствора 2,6-дихлорфенолиндофенолята натрия. 0.22 г 2,6-дихлорфенолиндофенолята натрия растворяют в 500 мл воды очищенной, выдерживают 10-12 часов, фильтруют в мерную колбу вместимостью 1 л и доводят объем раствора водой очищенной до метки. Срок годности раствора 7 суток.
Кислота аскорбиновая:
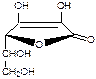 20 г целых или 10 г очищенных измельченных плодов, заливают 200 мл воды очищенной, настаивают в течение 1 часа с перемешиванием, фильтруют.
20 г целых или 10 г очищенных измельченных плодов, заливают 200 мл воды очищенной, настаивают в течение 1 часа с перемешиванием, фильтруют.
В коническую колбу вместимостью 50- 100 мл вливают 1 мл 2% раствора кислоты хлороводородной, 1 мл испытуемого раствора, 13 мл воды очищенной и титруют 0.001н раствором 2,6-дихлорфенол-индофенолята натрия до появления розовой окраски, не исчеза-ющей в течение 1 минуты.
1 мл 0.001н раствора 2,6-дихлорфенолиндофенолята натрия соответствует 0.000088 г аскорбиновой кислоты.
Если концентрация кислоты высокая, исходное извлечение разбавляют водой в 2 раза или более.
Содержание аскорбиновой кислоты в пересчете на абсолютно сухое сырье в процентах (X) вычисляют по формуле:
|
m . 1 . (100 - W)
где 0.000088 - количество аскорбиновой кислоты, соответствующее 1 мл раствора 2,6-дихлорфенолиндофенолята натрия (0.001 моль/л), в граммах;
V - объем раствора 2,6-дихлорфенолиндофенолята натрия (0.001 моль/л), пошедшего на титрование, в миллилитрах;
m - масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья, в процентах.
Примечания. Приготовление раствора 2,6-дихлорфенолиндофенолята натрия (0.001 моль/л): 0.22 г 2,6-дихлорфенолиндофенолята натрия раство-ряют в 500 мл свежепрокипяченной и охлажденной воды при энергичном взбалтывании (для растворения навески раствор оставляют на ночь). Раствор фильтруют в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки. Срок годности раствора не более 7 сут при условии хранения в холодном, темном месте.
Установка титра. Несколько кристаллов (3-5) аскорбиновой кислоты растворяют в 50 мл 2% раствора кислоты серной; 5 мл полученного раствора титруют из микробюретки раствором 2,6-дихлор-фенолиндофенолята натрия до появления розового окрашивания, исчезающего в течение 1-2 нед.
Другие 5 мл этого же раствора аскорбиновой кислоты титруют раствором калия иодата (0.001 моль/л) в присутствии нескольких кристаллов (около 2 мг) калия иодида и 2-3 капель раствора крахмала до появления голубого окрашивания
Поправочный коэффициент вычисляют по формуле:
К = V/V1
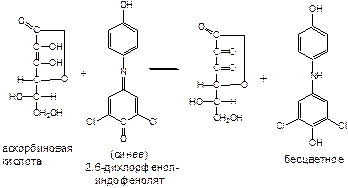 |
где V - объем раствора калия иодата (0.001 моль/л), пошедшего на титрование, в миллилитрах; V1 - объем раствора 2,6-дихлорфенолиндофенолята нат-рия, пошедшего на титрование, в миллилитрах [7].
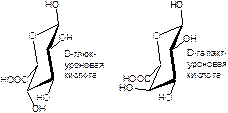 Кислоты глюкуро- и(или) галактуроновые.
Кислоты глюкуро- и(или) галактуроновые.
Около 0.2 г (точная навеска препарата) поме-щают в колбу вмести-мостью 50 мл, прибав-ляют 25 мл 0.1М раствора натрия гидроксида и раст-воряют при перемеши-вании и нагревании от 50 до 600С, охлаждают.
В колбу вместимостью 50 мл помещают 5 мл полученного раствора, прибавляют 1 мл 0.5% раствора карбазола, 5.5 мл сернокислого раствора мочевины и кислоты борной, перемешивают, нагревают в течение 15 минут на кипящей водяной бане, охлаждают, перемешивают и измеряют оптическую плотность при длинах волн 490 и 420 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения смесь, состоящую из 5 мл воды очищенной, 1 мл 0.5% раствора карбазола и 5.5 мл сернокислого раствора мочевины и кислоты борной, обработанную аналогично испытуемому раствору.
Содержание кислот глюкуроновой и(или) галактуроновой (Х) в пересчете на сухой препарат, вычисляют по формуле:
|
m . 5 . 563 . (100 - W)
где D – разность оптических плотностей испытуемого раствора при 490 и 420 нм;
m – масса навески препарата, в граммах;
W – потеря в массе при высушивании, в процентах;
563 – разность удельных показателей поглощения раствора кислоты галактуроновой (глюкуроновой) при длинах волн 490 и 420 нм;
11.5 – объем испытуемого раствора, в миллилитрах;
5 – аликвота испытуемого раствора, в миллилитрах.
Примечания. Приготовление 0.5% раствора карбазола. 0.5 г карбазола растворяют в спирте этиловом 95% в мерной колбе вместимостью 100 мл и доводят объем раствора до метки этим же растворителем. Срок годности раствора 3 месяца при хранении в холодильнике.
Приготовление сернокислого раствора моче-вины и кислоты борной. К 100 мл кислоты серной концентрированной прибавляют 0.3 г мочевины, нагревают на песчаной бане в течение 1 часа. Охлаждают, прибавляют 0.6 г кислоты борной, нагревают на песчаной бане в течение 1 часа. Срок годности раствора 3 месяца при хранении в холодильнике.
Кислоты жировые.
| СН3-(СН2)n-СООН | |
| n=4 – капроновая | n=10 – лауриновая |
| n=6 – каприловая | n=12 – миристиновая |
| n=8 – каприновая | n=14 – пальмитиновая |
| СН3-(СН2)7-СН=СН-(СН2)7-СООН | |
| олеиновая кислота | |
| СН3-(СН2)4-СН=СН-СН2-СН=СН-(СН2)7-СООН | |
| линолевая кислота |
Метод 1. Около 1 г (точная навеска) образца заливают 10 мл хлороформа, выдерживают при перемешивании 30 минут, фильтруют в мерную колбу вместимостью 10 мл, доводят объем до метки хлороформом.
К аликвоте анализируемого раствора и к СО (1% раствор кислоты пальмитиновой в хлороформе) добавляют по 15 мл 0.5% раствора дифенилкарбазона и дифенилкарбазида (5:95) и измеряют оптическую плотность испытуемого и стандартного раствора при длине волны 550 нм в кювете с толщиной слоя 10 мм.
Контрольный раствор: 0.5% раствор дифенилкарбазона и дифенилкарбазида (5:95) в метаноле.
Содержание жировых кислот в процентах (Х) вычисляют по формуле:
|
D0 . m
где С – содержание стандартной жирной кислоты;
D – оптическая плотность испытуемого образца при длине волны 550 нм;
D0 – оптическая плотность СО при длине волны 550 нм;
m – масса навески испытуемого образца, в граммах.
Метод 2. Испытуемый раствор. 2.0 мл субстанции помещают в круглодонную колбу вместимостью 50 мл, прибавляют 10 мл 10% раствора натрия хлорида, колбу присоединяют к установке для перегонки с водяным паром и отгоняют эфирные масла с водяным паром в течение 10 мин, собирая около 30 мл отгона. Охлажденный остаток в колбе помещают в делительную воронку вместимостью 50 мл с помощью 10 мл циклогексана, встряхивают в течение 5 мин, отстаивают до полного разделения слоев. Верхний (циклогексановый) слой фильтруют через бумажный фильтр с 0.5 г натрия сульфата безводного в мерную колбу вместимостью 20 мл. Воронку и фильтр промывают 5 мл циклогексана, присоединяя промывные растворы к предыдущим фильтратам. Объем раствора в мерной колбе доводят циклогексаном до метки и перемешивают (раствор 1).
0.5 мл раствора 1 помещают в круглодонную колбу вместимостью 10 мл прибавляют 0.5 мл эфира, 5 мл метанола и при непрерывном перемешивании прибавляют 0.1 мл ацетила хлористого. К колбе присоединяют обратный холодильник и нагревают при температуре 65-750С в течение 20 мин. Потом раствор выпаривают в токе инертного газа до остаточно объема около 0.25 мл, прибавляют 1.0 мл циклогексана и 0.5 мл воды очищенной. Смесь взбалтывают и выдерживают до полного разделения слоев. Используют верхний (циклогексановый) слой.
Раствор сравнения. По 0.20 г кислоты капроновой, капри-ловой, каприновой, лауриновой и миристиновой помещают в коническую колбу и растворяют в 10 мл метиленхлорида.
0.5 мл полученного раствора помещают в круглодонную колбу вместимостью 10 мл, прибавляют 5 мл метанола и при непрерывном перемешивании прибавляют 0.1 мл ацетила хлористого. К колбе присоединяют обратный холодильник и нагревают при температуре 65-750С в течение 20 мин. Затем раствор испаряют в токе инертного газа до остаточного объема около 0.25 мл, прибавляют 1.0 мл циклогексана и 0.5 мл воды очищенной. Смесь взбалтывают и выдерживают до полного разделения слоев. Используют верхний (циклогексановый) слой. Срок годности раствора 1 мес при температуре не выше +50С.
Хроматографирование проводят на газовом хроматографе с пламенно-ионизационным детектором при следующих условиях:
§ колонка капиллярная кварцевая размером 25м х 0.20 мм;
§ неподвижная фаза - SE-54 с толщиной слоя 0.25 мкм или аналогичная для которой выполняются требования теста "Проверка пригодности хроматографической системы";
§ температура колонки -1700С;
§ температура испарителя - 2200С;
§ температура детектора - 2200С;
§ скорость газа-носителя (азот) – 0.85 мл/хв;
§ коэффициент разделения потока 1:100.
Хроматографируют по 1 мкл раствора сравнения, получая не менее 5 xроматограмм.
Содержание каждой из жирных кислот в препарате, в процентах (Х), вычисляют по формуле:
|
SSi
где Si – среднее значение площадей пиков соответствующих кислот, вычисленное из хроматограмм испытуемого раствора;
SSi – среднее значение суммы площадей всех пиков (кроме растворителя!), вычисленное из хроматограмм испытуемого раствора.
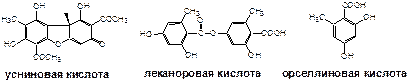 |
Кислоты лишайниковые.
Около 10 г (точная навеска) измельченного сырья помещают в аппарат Сокслета или в круглодонную колбу вместимостью 250 мл, прибавляют 100 мл спирта этилового 96% (хлороформа, ацетона, этилацетата) и экстрагируют на кипящей водяной бане в течение 2 часов. Охлаждают, фильтруют в коническую колбу, прибавляют 30 мл 10% раствора кальция карбоната и 10% раствор кислоты хлороводородной до прекращения образования мути. Водный слой отделяют в делительной воронке, прибавляют 10% раствор кислоты хлороводородной до образования осадка. Осадок отфильтровывают, промывают на фильтре водой, высушивают.
Сухой осадок растворяют в ацетоне, хлороформе или этилацетате; раствор пропускают через слой (2-3 см) силикагеля Л 51/40 М. Колонку промывают тем же растворителем. Элюат концентрируют, остаток высушивают до постоянной массы. (*)
Сухой остаток растворяют в любом указанном растворителе в мерной колбе вместимостью 50 мл, доводят объем раствора до метки и замеряют оптическую плотность полученного раствора при длине волны 290 нм в кювете с толщиной слоя 10 мм.
Содержание лишайниковых кислот в абсолютно сухом сырье в процентах (Х), в пересчете на кислоту усниновую, рассчитывают по формуле:
|
P . m . (100 - W)
где D – оптическая плотность испытуемого раствора при длине волны 290 нм;
m – масса навески сырья (препарата), в граммах;
W – потеря в массе при высушивании сырья, в процентах;
Р = 857 – удельный показатель поглощения раствора кислоты усниновой при длине волны 290 нм.
* Возможно определение кислот лишайниковых весовым методом [85].
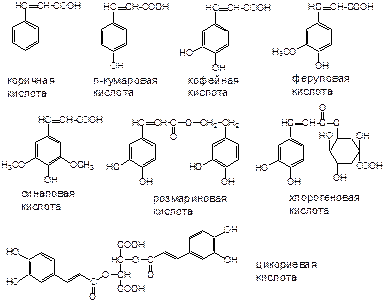
Кислоты оксикоричные содержатся в разных сочетаниях в свободном виде или в форме гликозидов практически в каждом высшем растении. Наиболее распостранена кофейная кислота и ее соединения, в частности хлорогеновая, представляющая собой 3-кофеиловый эфир хинной кислоты:
Как видно, кислоты оксикоричные относятся к кислотам фенолового типа.
Методы количественной оценки содержания оксикоричных кислот включают извлечение их из сырья водой или 10-40% спиртовыми растворами с последующим титрованием аликвоты извлечений или спектрофотометрическим методом с использованием СО любой оксикоричной кислоты.
Ниже приведена методика с пересчетом на кислоту цикориевую с удельным показателем при измеряемой длине волны.
Около 0.5 г (точная навеска) измельченного сырья помещают в круглодонную колбу вместимостью 50 мл, прибавляют 35 мл спирта этилового 40% и нагревают с обратным холодильником на кипящей водяной бане в течение 2 часов, охлаждают, фильтруют.
1 мл полученного фильтрата помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой очищен-ной до метки и перемешивают.
[5 мл препарата (капли, раствор, сок) помещают в мерную колбу вместимостью 50 мл, доводят объем раствора водой очищенной до метки и перемешивают.] (*)
Измеряют оптическую плотность полученного раствора на спектрофотометре при длине волны 330 нм в кювете с толщиной слоя 10 мм.
В качестве раствора сравнения используют воду очищенную.
Содержание производных гидроксикоричных кислот в пересчете на кислоту цикориевую в абсолютно сухом сырье (Х1) или в препарате (Х2) в процентах вычисляют по формуле:

|
m . 1 . 782 . (100 - W)
|
782 . m
где D – оптическая плотность испытуемого раствора при длине волны 330 нм;
m – масса навески сырья, в граммах;
W – потеря в массе при высушивании сырья, в процентах;
782 – удельный показатель поглощения цикориевой кислоты в воде очищенной при длине волны 330 нм.
* При низком содержании гидроксикоричных кислот, разведение можно опустить [86,87].
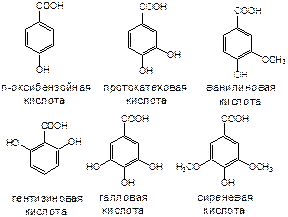 |
Кислоты феноловые.
Метод 1. Около 1 г (точная навеска) измельченного сырья помещают в колбу круглодонную, прибавляют 50 мл спирта этилового 70-90%, экстрагируют на кипящей водяной бане в течение 2 часов. Охлаждают, фильтруют в мерную колбу вместимостью 100 мл, доводят объем раствора до метки спиртом этиловым.
* 5 мл препарата (настойки, жидкие экстракты) помещают в мерную колбу вместимостью 100 мл, доводят объем раствора до метки спиртом этиловым.
Измеряют оптическую плотность полученного раствора при длине волны 290 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения спирт этиловый 96%.
Содержание кислот феноловых в препарате или в сырье, в процентах (Х), вычисляют по формуле:
|
P . V2 . [m . (100 - W)]
где D – оптическая плотность испытуемого раствора при длине волны 290 нм;
V1 – объем испытуемого раствора, в миллилитрах;
V2 – объем аликвоты испытуемого раствора, в миллилитрах;
m – масса навески сырья в граммах;
W – потеря в массе при высушивании сырья, в процентах;
Р – удельный показатель поглощения раствора СО при длине волны 290 нм = 510 для кислоты галловой, 464 – для кислоты кофейной, 616 – в пересчете на цинарин при длине волны 325 нм, 470 – в пересчете на хлорогеновую кислоту в спирте этиловом 60% при 328 нм.
* Методика пригодна и для анализа лекарственных форм.
Метод 2.2 г препарата помещают в стакан вместимостью 100 мл, прибавляют 10 мл 10% раствора кислоты уксусной и тщательно перемешивают, фильтруют и промывают 10% раствором кислоты уксусной до исчезновения желтого окрашивания фильтра. Полученный раствор пропускают через слой силикагеля L40/100, собирая раствор в мерную колбу вместимостью 100 мл. Стакан промывают дважды 10 мл 10% раствором кислоты уксусной и промывной раствор также пропускают через колонку до получения объема 100 мл (элюат).
* 10 мл полученного раствора помещают в мерную колбу на 100 мл (V1) и доводят объем раствора спиртом этиловым 50% до метки.
Измеряют оптическую плотность полученного раствора при длине волны 325 нм. В качестве раствора сравнения используют спирт этиловый 50%.
Содержание суммы фенолокислот в препарате в мг/100 мл, в пересчете на цинарин, рассчитывают по формуле:
|
616 . V . m
где D – оптическая плотность испытуемого раствора при длине волны 325 нм;
V1 – объем испытуемого раствора, в миллилитрах;
V – объем элюата, добавленного в испытуемый раствор, в миллилитрах;
m – масса навески препарата, в граммах;
d – относительная плотность испытуемого раствора препарата;
616 – удельный показатель поглощения цинарина при длине волны 325 нм в спирте этиловом 50%.
* При низком содержании фенолокислот стадию разбавления можно опустить.
