Теоретические основы потенциометрического метода анализа. Аппаратура. Характеристика метода
Потенциометрический метод анализа основан на измерении величины потенциала электрода, опущенного в раствор электролита. При погружении металлического электрода (пластинки) в раствор хорошо растворимой соли того же металла между твердой и жидкой фазами устанавливается равновесие:
Ме0  Men+ + n
Men+ + n 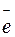 .
.
Металлическая пластинка заряжается, т.е. приобретает вполне определенный потенциал, величина которого зависит как от природы металла, так и от природы и концентрации (активности) раствора. Величина этого потенциала определяется уравнением Нернста:
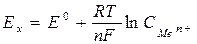 ,
,  (1)
(1)
где Ex – потенциал металлического электрода при данной концентрации ионов, в;
E0 – стандартный электродный потенциал, в;
СMen+ – концентрация потенциалобразующих ионов, моль/л.
Для реальных растворов уравнение Нернста записывается в виде:
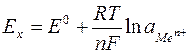 , (2)
, (2)
где 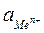 – активность потенциалобразующих ионов.
– активность потенциалобразующих ионов.
Активность определяется по уравнению:
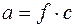 , (3)
, (3)
где f – коэффициент активности.
Так как в разбавленных растворах коэффициент активности равен
единице, а при титровании растворов концентрация и активность изменяются в одинаковой степени, то можно пользоваться формулой Нернста (1). После подстановки значения величин F и R получается следующая форма уравнения Нернста:
при Т = 180С = 291К Þ 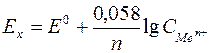 , (4)
, (4)
при T = 250C = 298К Þ 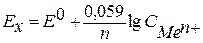 . (5)
. (5)
Если платиновый электрод опустить в смесь окислителя и восстановителя, то уравнение примет вид:
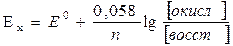 . (6)
. (6)
Для электрода Pt | Fе2+ Fе3+:
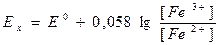 . (7)
. (7)
В случае, если в реакции принимают участие ионы водорода, величина потенциала будет зависеть от их концентрации, например, при титровании восстановителя раствором перманганата калия (KМnO4) в кислой среде, по реакции:
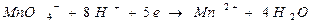 ,
,
для окислительно-восстановительного электрода:
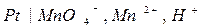 ,
,
уравнение Нернста будет иметь вид:
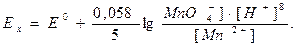
 (8)
(8)
Прямого метода измерения потенциала не существует. Для его определения используют косвенный метод, основанный на сравнении потенциала одного электрода с потенциалом другого электрода.
Два электрода, погруженные в соответствующие растворы, имеют свои собственные потенциалы и образуют гальванический элемент, ЭДС которого равна алгебраической разности этих потенциалов:
ЭДС = Е1 – Е2
Электроды подбирают таким образом, чтобы один электрод имел потенциал, зависящий от концентрации потенциалобразующих ионов, а другой имел постоянный потенциал. Такой электрод называется электродом сравнения. В качестве электродов сравнения используются нормальный водородный электрод (НВЭ), каломельный и хлорсеребряный электроды. Замечательным достоинством НВЭ является то, что его потенциал равен 0 В, т.е. получается, что измеряемая ЭДС по величине равна электродному потенциалу изучаемого электрода.
Потенциал электрода, погруженного в раствор соответствующей соли с активностью ионов 1 моль-ион/л, измеренный относительно НВЭ, называется нормальным электродным потенциалом.
Величина нормального электродного потенциала зависит от природы металла:
для электрода 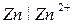
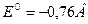
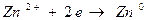
для электрода 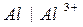
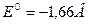
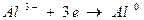
для электрода 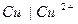
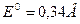
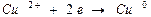
 Вышеуказанные электроды относятся к электродам I рода. Электродом I рода называется электрод, представляющий собой металл, опущенный в раствор, содержащий хорошо растворимую соль этого металла и обратимый вокруг этого катиона.
Вышеуказанные электроды относятся к электродам I рода. Электродом I рода называется электрод, представляющий собой металл, опущенный в раствор, содержащий хорошо растворимую соль этого металла и обратимый вокруг этого катиона.
Нормальный водородный электрод (НВЭ) тоже относится к электродам I рода:
Pt(H2) | H+ 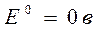 Н2 – 2 е ® 2Н+
Н2 – 2 е ® 2Н+
Он представляет собой платиновую пластинку, покрытую платиновой чернью, опущенную в раствор серной кислоты с активностью ионов водорода [H+] = 1 моль-ион/л. Через раствор пропускается водород, который адсорбируется платиновой чернью. Установившееся равновесие соответствует уравнению:
2Н+ + 2е  Н2.
Н2.
При эксплуатации НВЭ возникает ряд проблем:
1. Проблема получения водорода.
2. Проблема поддержания давления водорода постоянным р (Н2) = 1 атм.
3. Большое усложнение установки (выпрямитель, устройство для
электролиза NaOH, очистка водорода от примесей).
Поэтому на практике вместо НВЭ применяют другие электроды сравнения. В качестве электродов сравнения используются электроды II рода. Электродом II рода называется электрод, представляющий собой металл, покрытый слоем своей трудно растворимой соли, содержащей одноименный анион и обратимый по отношению к этому аниону. Примерами электродов II рода могут служить каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из металлической ртути и раствора KCl, насыщенного относительно каломели:
Hg | Hg2Cl2 | Cl-.
При работе каломельного электрода протекает следующая реакция:
2Hg0 + 2Cl-  Hg2Cl2 + 2e.
Hg2Cl2 + 2e.
Потенциалы такого электрода, измеренные относительно НВЭ при различных температурах и концентрациях раствора KCl, приведены в табл.1.
Потенциалы каломельных электродов
Таблица 1
| С, моль/л | 18 0С | 20 0С | 25 0С |
| 0,1 1,0 насыщ. | 0,3369 0,2845 0,2483 | 0,3368 0,2840 0,2471 | 0,3365 0,2828 0,2438 |
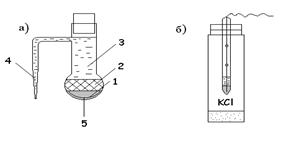
Рис.1. Каломельный электрод
Каломельный электрод промышленного изготовления (рис.1а) представляет собой стеклянную трубку с шариком на конце, заполненную ртутью (1) и каломелью (2). Трубка заполнена раствором хлорида калия (3). Соединение с другим раствором осуществляется через капилляр (солевой мостик) (4). В нижнюю часть шарика впаяна платиновая проволока (5) для контакта. Более удобной является форма каломельного электрода, представленная на рис.1б, когда внизу трубочки впаивается пористая перегородка, выполняющая роль солевого мостика. Каломельный электрод легко можно изготовить в лабораторных условиях, причем придать ему любую форму, так как капилляр является довольно хрупким соединением, его легко можно разбить, что нежелательно.
Каломельный электрод очень устойчив в работе, но обладает единственным недостатком – наличием в его составе ртути.
Хлорсеребряный электрод в настоящее время является более распространенным электродом, его схема представлена на рис. 2.
Хлорсеребряный электрод представляет собой стеклянную трубку, внутри которой помещена серебряная проволочка (1), покрытая плохо растворимой солью хлорида серебра AgCl (2) и погруженная в насыщенный раствор хлорида калия (3). Солевой мостик представлен узким отверстием, заполненным асбестом (4).
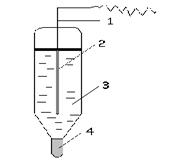
Рис.2 Хлорсеребряный электрод
Хлорсеребряные электроды входят в комплекты многих лабораторных измерительных приборов, выпускаются промышленностью. Каждый электрод имеет свой паспорт, где указывается его потенциал.
В среднем потенциал хлорсеребряного электрода равен Ехс = 0,222 В. Записывается хлорсеребряный потенциал следующим образом:
Ag | AgCl | KCl.
При его работе осуществляется следующая реакция:
Ago + Cl- ® AgCl + 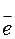 .
.
Потенциал хлорсеребряного электрода можно вывести из уравнения Нернста для электродов I рода:
Exc = Eo + 0,059 lg[Ag+].
Так как хлорид серебра является малорастворимой солью, то концентрацию ионов серебра для реакции:
AgCl  Ag+ +Cl-
Ag+ +Cl-
можно вычислить из произведения растворимости соли:
ПР = [Ag+] [Cl-].
Отсюда находим концентрацию ионов серебра [Ag+] = 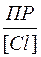 .
.
Подставляем полученное значение в уравнение Нернста:
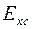 =
= 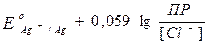 .
.
Расписываем логарифм частного как разность логарифмов:
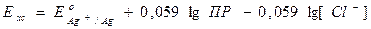 .
.
Величина 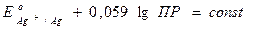 , и обозначим её как
, и обозначим её как 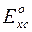 , тогда уравнение Нернста для электродов II рода примет вид:
, тогда уравнение Нернста для электродов II рода примет вид:
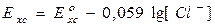 . (9)
. (9)
Хлорсеребряный электрод в настоящее время является самым распространенным электродом, так как обладает следующими достоинствами:
1) держит постоянный потенциал в течение очень длительного времени,
2) механически устойчив,
3) не капризен в работе,
4) работает в среде окислителей и восстановителей,
5) может применяться в реакциях нейтрализации, осаждения, комплексообразования, окисления-восстановления.
К его недостаткам можно отнести погрешности, возникающие в случае, если анализируемый раствор содержит ионы Cl- и (или) Ag+.
Потенциометрический методы анализа подразделяют на прямую потенциометрию(ионометрию) и потенциометрическое титрование. Методы прямой потенциометрии основаны на прямом применение уравнения Нернста, для нахождения или концентрации участников электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода. При потенциометрическом титрование т-ку эквивалентности определяют по резкому изменению (скачку) потенциала в близи т-ки эквивалентности.
