Основные уравнения для титриметрического анализа
N1V1 = N xV x,
где N1 – нормальность титранта
V1 – количество раствора, которое вылили из бюретки для химической реакции
N xV x – характеристика искомого вещества
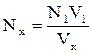
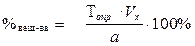
а – навеска анализируемого вещества
Пример 1.
Из 2,500 г Na2CO3 приготовили 500,0 мл раствора. Рассчитать для этого раствора: а) молярную концентрацию, б) молярную концентрацию эквивалента, в) титр, г) титр по HCl.
Решение.
а) Молярная концентрация - это количество молей вещества, содержащееся в
1 литре раствора. n (Na2CO3) в 500 мл
Тогда, в 1 литре или в 1000 мл содержится:
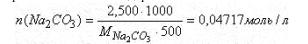
Таким образом С (Na2CO3) = 0.04717 моль/л.
б) Если не оговорено особо, то в основе титрования предполагается реакция
Na2CO3 + 2HCl = 2NaCl2 + H2CO3 и фактор эквивалентности равен 1/2.
Молярная масса эквивалента, следовательно, равна 1/2 М(Na2CO3).
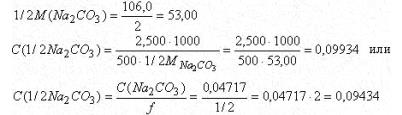
в) По определению: титр - это масса вещества в граммах, содержащаяся в 1 мл раствора
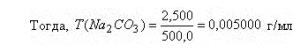
г) Титр по определяемому веществу - это количество граммов определяемого
вещества, которое эквивалентно 1 мл раствора соды. Если 2.5/500 - масса соды, содержащаяся в 1 мл раствора, то число молей- 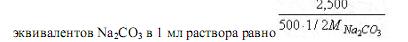
По закону эквивалентов, столько же молей эквивалентов HCl соответствует 1 мл раствора соды. Тогда масса НС1, соответствующая одному мл раствора соды, равна:
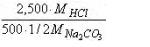
Это и есть по определению титр раствора Na2CO3 по HCl.
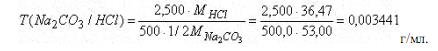
Титр раствора Na2CO3 по HCl можно рассчитать и другим способом. Например, исходя из молярной концентрации эквивалента раствора Na2CO3
C(1/2Na2CO3) - число молей эквивалентов Na2CO3 в 1 литре или 1000 мл раствора
C(1/2Na2CO3)/1000 - число молей эквивалентов Na2CO3 в 1 мл раствора. По закону эквивалентов столько же эквивалентов HCl соответствует 1 мл раствора соды.[C(1/2Na2CO3)/1000]-M(HCl) - масса HCl в граммах, соответствующая 1 мл раствора
Na2CO3, т. е.
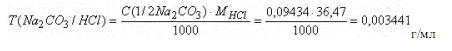
Ответ: Т = 0,0034 г/мл.
Тема 4. Метод кислотно-основного титрования. [4] стр.205-255
В основе кислотно-основного титрования лежит реакция нейтрализации и в процессе титрования изменяется рН раствора. Поэтому при изучении данной темы необходимо уметь правильно определять состав раствора и рассчитывать рН в ходе титрования. Для правильного выбора индикатора важно знать, что такое точка эквивалентности, скачок рН, точка начала скачка и конца, чем определяется величина скачка рН, и, что такое интервал перехода окраски индикатора и его показатель титрования - рТ.
Пример 1.
Рассчитать рН в точке эквивалентности при титровании 20 мл 0,1 М раствора муравьиной кислоты (KHCOOH = 1,8 10-4) 0,2 М раствором KOH. Подобрать индикатор.
Решение.
Напишем уравнение реакции:
HCOOH + KOH - HCOOK + H2O
рН в точке эквивалентности определяется гидролизом соли.
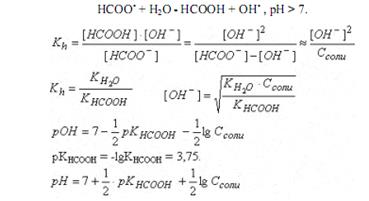
В точке эквивалентности объем титранта (КОН) равен
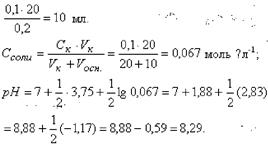
Таким образом, при титровании муравьиной кислоты раствором гидроксида калия рН в точке эквивалентности равен 8,29. Индикатор - фенолфталеин (рТинд. = 9).
При проведении количественных расчетов в методе кислотно-основного титрования используется закон эквивалентов. Особое внимание следует обратить на используемые индикаторы, с тем, чтобы правильно определить фактор эквивалентности реагирующих веществ.
