Термод-кие основы работы тепловых двигателей. Циклы тепловых двигателей, и их эфф-ность. Основные элементы теплового двигателя и принцип преобразования в них энергии
Тепловой двигатель-тепл.машина, в кот. Е подв-ая посредством теплообмена (теплота), с помощью раб тела, преобразуется в мех.энергию (работу).
Тепл.двиг.состоит из: 1)источник теплоты (Ти), 2) теплоприемник (хо-
лодильник) Тх < Ти , 3) раб.тело.
Часто в роли холод –ка выступает окр.среда.
Принцип работы. Закл –ся в преобразовании в механич.работу части теплоты (Q1-Q2) в процессе необратимого теплопереноса от ист –ка теплоты к хол –ку за счет прямых круговых процессов, осущ – х с помощью раб.тела. 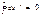
к=2; 1 закон тд.:ΔU=Qe-Le;L=Qe- ΔU.
Полученная работа мб получена из подводимого тепла или убыли внутр.энергии.
А. Работа тепл.двигателя за счет к-л т/д процесса.
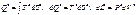
а) Qe=0, S=const, L=-ΔU
(адиаб.изотропный процесс)
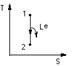
L=-Cv(T2-T1)
Работа в этом процессе происходит за счет
↓ внутр.энергии U→Le.
Внутр.эн.можно превратить в L лишь частично.
В отдельном т/д процессе можно получить ограниченное кол-во работы.
б) Т=соnst, U=f(T), Le=Qe (изотерм. процесс)
ΔU=0-для ид. газа
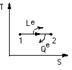
Б.Дв-ли непрерывного (длительного) действия
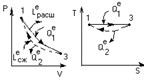
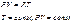
Qц =Q1 –Q2 >0 (Q1>Q2)
LРАСШ-|LСЖ|=LЦ>0;
ΔU=0, LЦ =Qц.
Эф –ть цикла опред –тся терм.КПД: 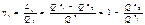
43.Диф Ур тд устанавливают кол-ые характеристики между различными физич свойствами в-ва, вытекающих из основных зак тд. В случае, когда часть параметров оказывается известной, остальные параметры м б найдены путем интегрирования соответствующих дифференциальных уравнений.

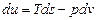 (1)
(1)
Независимые переменные v и Т:
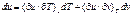 -для внутренней энергии (2)
-для внутренней энергии (2)
Частные производные входящие в это выражение можно найти ч/з термодинамические параметры и их проихводные. Так из (1) следует, что при Т=const
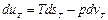 ,откуда
,откуда
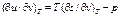 (3)
(3)
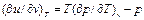 (4)
(4)
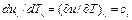 (5) ,подставляем (4) и (5) в (2)
(5) ,подставляем (4) и (5) в (2)
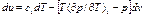 (6)
(6)
Дифференциальное уравнение для энтропии можно получить совместно решая уравнеия (1) и (6)
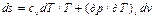
Независимые переменные р и Т: Энтальпия является функцией состояния, поэтому:
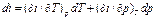
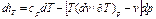
44. Т/д осн. раб.теп.двг. Прямой обратимый цикл Карно и его роль. Сравнение с другими идеальными циклами теп. двг.
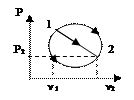
При совер-ии цикла Карно тд-ая сист вд-ет только с 2мя телами, имеющими пост т-ру. Т к имеется 2 тела с постоянными, но разными т-ми ТI и Т2(Т1> Т2),то одноиз них д б использовано для подвода теплотыql к системе, а другое - для отвода теплоты q2от системы. Тк т-ры тел постоянны, а пр-сы подвода и отвода теплотыд б равновесными, то эти пр-сы м б только изотермными, т. е. протекать при постоянных т-рах T1=const и Т2=соnst. Т-ра раб тела в цикле долж изменяться от ТI до Т2 без теплообмена с окр ср, т. е. в адиабат процессах. Т о, цикл Карно состоит из двух изотерм и двух адиабат.В пр-се АВ рабочее тело получает кол-во теплоты q1, в рез-те его энтропия возрастает отзначения sA до значения sB на величину DsAB=q1 / T1. Далее следует адиабатное расширение (линия ВС), в ходе кот т-ра раб тела уменьш отТ1 до Т2. При т-ре Т2 протекает изотермный процесс (линия CD), в ходе кот раб тело отдает приемнику такое кол-во теплоты q2, что энтропия тела отзначения sC=sB снова возвращается к значению sA =sD; сл-но, DsCD= -DsAB=q2/Т2. Цикл завершается адиабатным сжатием (линия DA), в ходе кот т-ра повыш отT2 до T1, принимая первонач значение. Выражение для термического кпд равновесного цикла Карно получается из общвыражения подстановкой в него величин ql и |q2|, выраженных через т-ру и изменение энтропии на участках АВ и CD: ht = 1-|q2|/ql = 1- Т2|DsСD|/(T1DsAB).Так как |DsCD|= DsAB , то htK= 1- T2/TI (3.6) Кпд цикла Карно зависит только от т-ры Т1 источника и Т2 приемника теплоты и не зависит от рода рабочего цикла. Этот вывод составляет содержание так называемойтеоремы Карно. Цикл Карно имеет наибольший термический кпдпо сравнению с другими циклами в интервале температур Т1 - Т2. Для док-ва этогоутверждения следует сравнить на sT-диаграмме (рис. 3.3) цикл Карно ABCD с произвольным циклом abcd, проходящим между теми же температурными границами. Для цикла Карно htК = 1-|q2К|/qlK. Из диаграммы видно, что q2K = пл.еDС', а q1K = пл.еАВf. Соответственно для произвольного цикла ht = 1-|q2|/ql , где q2 = пл.еаdсf, а q1 = пл.еаbсf. Сравнивая соответствующие площади, замечаем, что q2K<q2,а q1K> ql. Отсюда q2K/qIK<q2/ql.Сл-но, htK> ht. Эффективность превращения теплоты в работу (термический кпд) в любом другом цикле не Мб больше, чем в цикле Карно, осуществляемом в том же интервале т-р.Фундаментальное знач полученного рез-та состоит в том, что он устанавливает предел кпд тепловых двигателей. Взяв частные производные от htKсоответственно по T1и Т2, можно получить выражения, показывающие влияние изменения температур TIи Т2источников теплоты на кпд цикла Карно: . 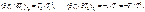 Так как TI>T2, то, следовательно,
Так как TI>T2, то, следовательно, 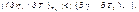 Это значит, что измен т-ры Т1, источника теплоты влияет на кпд меньше, чем изменение т-ры Т2 приемника теплоты.Так как не существует ни источников теплоты с бесконечно высокой температурой
Это значит, что измен т-ры Т1, источника теплоты влияет на кпд меньше, чем изменение т-ры Т2 приемника теплоты.Так как не существует ни источников теплоты с бесконечно высокой температурой 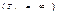 , ни приемников теплоты с т-рой, равной абс 0
, ни приемников теплоты с т-рой, равной абс 0 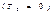 , то отношение Т2/ТI всегда больше нуля. Сл-но, кпд цикла Карно и тем более любого другого цикла всегда мень 1.Кпд цикл Карно тем больше, чем меньше отношение T2/TI , т. е. чем ниже т-ра Т2 и выше т-ра TI. Хотя в наст вр технически возможно получение очень высоких т-р (сотни тысяч градусов), однако в реальных двигателях использовать эти т-ры невозможно, так как материалы, из кот изготовлены детали двигателей, не способны выдерживать такие т-ры. Макс практически реализуемая в большинстве авиадвигателей температура близка к 1000...2000 К. Имеются двигатели (например, ракетные), в которых используются более высокие температуры (до 4000 К). Однако эти двигатели рассчитаны на очень короткий срок службы.Т-ра Т2 составляет приблизительно 300 К, поскольку приемником теплоты для всех двигателей, работающих в наземных условиях, является либо атмосферный воздух, либо вода в реках, морях и других водоемах. Может быть получена и температура, близкая к абс 0, однако получение температур ниже т-ры окр ср связано с затратой работы. Затрата работы оказывается боль, чем выигрыш в кпд, поэтому такой путь увеличения кпд неприемлем.
, то отношение Т2/ТI всегда больше нуля. Сл-но, кпд цикла Карно и тем более любого другого цикла всегда мень 1.Кпд цикл Карно тем больше, чем меньше отношение T2/TI , т. е. чем ниже т-ра Т2 и выше т-ра TI. Хотя в наст вр технически возможно получение очень высоких т-р (сотни тысяч градусов), однако в реальных двигателях использовать эти т-ры невозможно, так как материалы, из кот изготовлены детали двигателей, не способны выдерживать такие т-ры. Макс практически реализуемая в большинстве авиадвигателей температура близка к 1000...2000 К. Имеются двигатели (например, ракетные), в которых используются более высокие температуры (до 4000 К). Однако эти двигатели рассчитаны на очень короткий срок службы.Т-ра Т2 составляет приблизительно 300 К, поскольку приемником теплоты для всех двигателей, работающих в наземных условиях, является либо атмосферный воздух, либо вода в реках, морях и других водоемах. Может быть получена и температура, близкая к абс 0, однако получение температур ниже т-ры окр ср связано с затратой работы. Затрата работы оказывается боль, чем выигрыш в кпд, поэтому такой путь увеличения кпд неприемлем.
45. Термические коэф хар-т тепловые и упругие св-ва тел. Известны коэф теплового расширения α , термический коэф давления β и изотермический коэфф сжимаемости γ.
При нагревании определенной массы в-ва при постоянном внешнем давлении изменение объема на каждый градус повышения т-ры выражается производной 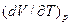 . Относительное изменение объема при нагревании на один градус – коэффициент объемного расширения
. Относительное изменение объема при нагревании на один градус – коэффициент объемного расширения
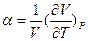
для идеального газа α=1/T.
Если нагревать данную массу в-ва при постоянном объеме, то относительное изменения давления при изменении т-ры харак-ся термическим коэф- давления β
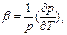 , р- давление при Т. Для идеального газа β= α=1/Т.
, р- давление при Т. Для идеального газа β= α=1/Т.
При изотермическом сжатии данной массы в-ва отношение изменения объема при изменении давления на единицу давления к объему- изотермический коэффициент сжимаемости:
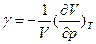 , знак минус означает уменьшение объема с увеличением давления.
, знак минус означает уменьшение объема с увеличением давления.
Ой З-н термод. для З Т С
2-й з-н термод. позволяет указать направление теплового потока и устанавливает максимально возможный предел превращения теплоты в работу в тепл.машинах.
а) Имеется подвод и отвод теплоты
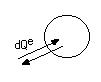 Данное выражение явл. формулировкой 2 з. термод., энтропия увелич..
Данное выражение явл. формулировкой 2 з. термод., энтропия увелич..
б) Воздействие в форме работы
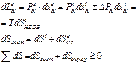
в) теплота+работа
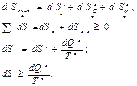
48. понятие об эксерги . эксерг-кий КПД. Эксергия количества теплоты. Экс.,та часть Е, кот. мож превратить в полезную работу (предельная величина). Виды эксергии: 1.Эксергия рабочего тела – тдля систем, включающих рабочее тело и окруж-ю среду. В этих сист исп-ся внутр.-я и внеш.-я энергия раб.тела. Различают эксергию покоящегося раб.тела и его потока.
2. Эксергию потока Е, включающую эксергию теплоты ( для систем, состоящих из источников теплоты, раб.тела и окруж.среды). Max-ное кол-во полезной работы, кот можно получить в цикле при заданных т-рах источников теплоты, назыв. работоспособностью (эксергией теплоты). Max-ную работу в тепл.двиг. мож получить по циклу Карно ηt=Lmax/Q=1-T2/T1, Q- кол-во тепл. подведенное ;T1 иT2 – t-ры высшего и низшего источника теплоты; Lmax – максимальное кол-тво работы, кот мож получить в обратимом цикле. Lmax=Emax=Q1(1-T2/T1)
(1-T2/T1) – коэфт эксерг-кой теплоты. Emax=q1-T2q1/T1. для получения полезной работы используется лишь часть некот кол-ва теплоты q1, а часть “=” q=T2q1/T1 рассеивается в окр.ср в реальном процессе добавляются потери, возникающие вследствие его необратимости. В необратимых процессах она уменьшается, превращаясь в анергию. Если энергия бесполезно рассеивается в окруж.среду, то вся эксергия превращается в анергию .
Эксергетический КПД определяется отношением исп-ой эксергии к подведенной.
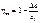
где Δе-разность подв. и отв. эксергий; е1-подв. эксергия.
Эксерг. КПД позволяет учесть потери только из-за необратимости процесса, так как лишь в необратимых процессах происходит потеря эксергии, а для всех обратимых процессов ηе=1.
49.Физические величины, значения кот однозначно определяются состоянием системы и не зависят от ее предыстории, называютсяпараметрами состоянияили функциями состояния системы.
2 вида параметров состояния: координаты тд-ого состоянияи потенциалы вд-й.
Параметры состояния, обязательно изменяющиеся при наличии вд-я данного рода и не изменяющиеся под влиянием вд-я иных родов, наз координатами тд-ого состояния.
Потенциалом вд-янекот рода наз параметр состояния, различие значений кот между системой и окр ср на контрольной пов-ти приводит к возникновению вд-я данного рода, т.е. к передаче энергии в данной форме между системой и окружающей средой.
Ур-я, представляющие зав-ть параметров (функций) состояния равновесной сист от независимых параметров состояния, называютсяур состояния тд-ой системы.
Если обозначить произвольную функцию состояния системы через φ, а координаты состояния -- через x1, x2, …, xn (п - число координат состояния, т. е. термодинамических степеней свободы), то уравнение состояния можно представить в виде : φ = φ (x1, x2, …, xn ).
Тд-им процессомназывается изменение состояния тд-ой системы в рез-те ее вд-ия с окр ср.
Тд-ий процесс, протекающий с нарушением внутреннего равновесия в тд-ой системе, называетсянеравновесным
Тд-ий процесс, протекающий с бесконечно малым отклонением состояния системы от равновесного состояния, называетсяравновесным.
Эксергия З Т С.
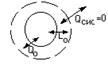
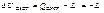
совершает работу за счет изм – я внутр.эн Lmax=-ΔUc/c=u/ –и//, u/ – внутр.эн.сист в нач.состоянии, u//- -/- в конечном сост.
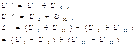
а) То=const
б) Po=const
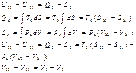
(сумма изменений обьема =0). Из усл – я получения Lmax принимаем 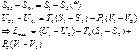 |
Равенство (*) справедливо только для обратимого взаимод-я,кот. опред-т Lмах.
Для получения самой величины экс. необх. положить конечн.сост. системы соот-ми параметрами окр.среды.
u2 =u0, s2=s0, v2=v0,
℮З Т С=(U1-U0) – T0(S1-S0) +P0(V1-V0).
Чем > S1 тем < работоспособ- ть сист.
Экс. внутр-й энергии – это часть (доля) вн.энергии, кот. в идеале превратима в полезную работу.
Δ℮И=(U1-U2) – T0(S1-S2) +P(V1-V2).
51. 2 зак является эмпирическим. Известно много различных формулировок, но его физичческая сущность наиболее четко расскрывается в формулировке, данной Больцманом.Он подчеркнул сво-во природы стремиться из состояний менее вероятных к более вероятным. Для ТД системы наиболее вероятным яв-ся состояние ТД равновесия. Если ТД систему вывести из равновесия, то за счет естественных процессов теплообмена сист прийдет к состоянию ТД равновесия. На этом факте основывается формулировка Клаузиса : теплота сама собой переходит лишь от тела с более высокой и не может самопроизвольно переходить обратно. Сл-но, равновесие мож нарушиться т-ко от внешнего воздействия окр. ср. 2 закон ТД, определя.щий условия протекания процессов в опр. направлении имеет чрезв. важное значение для обеспечения эффект. работы машин.
Энтропияизолированной сист им макс в стостоянии равновесия, когда в сист нет разностей температур и становятся невозможными самопроизвольные процессы. Это свойство энтропии изолированной системы можно рассматривать как одну из формулировок 2 закона ТД: энтропия всякой изолированной системы стремиться к максимуму.
52. Энерг.хар-ки термод. с/с – мы и внеш. возд-вии на нее.
Терм. сист. – объект, кот.выбирает терм-ка – это совок-ть макротел, отдельное макротело или его часть. Энерг.хар-ки: Е (внутр.эн.). Е явл мерой различных форм движения материи. Полная Е макросистемы: E=Eкин + Епот +U, где U – внутр.эн. Внутр.эн. – это Е заключенная в с/с. Она состоит из:
1) кинетич.Е поступательного, вращат. и колебат.движения молекул.
2) потенциал.Е.взаимод- вия молекул м/у собой (силы притяжения и отталкивания ). Свойства внутр.эн.
U=f(T,ν) U=f(P,T) U=f(P,ν) U – функция состояния 1) ΔU= U2 – U1, т.е.не зависит от пути
перехода
2) 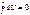 свойство полного диф –ла :
свойство полного диф –ла :

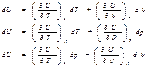
3) для ид.газа : U=f(T)
4)свойство аддетивности: 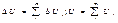
 т.е.для сложной с/с внутр.эн.есть сумма внутр.Е, составляющих частей этой с/с ΔU > 0, если U2 > U1. Энерг.внеш.возд–вие:
т.е.для сложной с/с внутр.эн.есть сумма внутр.Е, составляющих частей этой с/с ΔU > 0, если U2 > U1. Энерг.внеш.возд–вие:
1) тепловое возд. – передача Е за счет хаотич –го неупор – го движ –я частиц. Такая передача Е происходит м/у телами, имеюш –ми различ-ю t-ру , либо м/у телами на расст –ии посредством эл.магн.волн. Передача Е происходит от более нагретых тел к менее нагретым. Кол – во Е при такой передаче наз.кол –вом теплоты.
2) Работа – передача Е за счет строго упоряд – го движ – я частиц. В этом сл –е передача Е происходит при перемещении всего тела или его части в простр –ве. Возд – вий в виде работы очень много. Lмагн, Lвращ, Lмех и др., [Дж]. Работа, затраченная телом ‘+’, а совершенная телом ‘-’ . Ур возд – вия: 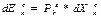
Рк – силы (потенциалы), кот.связаны с внеш.возд. Хк – коор –та, предт – ет собой конкр.- й пар –р, кот.изменяет- ся соот – но этому виду возд – вия. Рк – причины возник – я внеш.- х возл- вий. Возд – вия возникают тогда, когда есть разность сил. ΔРк= Рек – Рiк , Хек – следствие возд –. 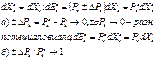
 сильное неравномерное возд.→ в с/с протекаеют неравн –е процессы.
сильное неравномерное возд.→ в с/с протекаеют неравн –е процессы. 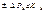 - хар.степень нерав –ти.
- хар.степень нерав –ти.
к=2
- термодиф – формация с/с (м.б.откр.и закрытой) Число независимых пар – ров с/с (степеней свободы)= числу внеш. энерг- ких возд –вий.
