Анодные процессы в водных растворах
Лабораторная работа № 1.
Электролиз растворов.
Цель работы: Изучить электродные процессы при электролизе растворов.
Общие сведения.
Окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита у электродов при пропускании постоянного электрического тока, называется электролизом.
Таблица №1.
Катодные процессы в водных растворах
| Электрический ряд напряжений металлов | ||
| Li, K, Ca, Na, Mg, Al | Mn, Zn, Fe | Ni, Sn, Pb Н2 Cu, Ag, Pt, Au |
| 2Н2O+ 2e→ Н2+2OHֿ Меn++nОН-= =Ме(ОН)n-католит | Выделяется Н2 или Ме | Men++ne-=Me0 |
Таблица №2.
Анодные процессы в водных растворах
| Анод | Кислотный остаток Асm- | |
| Бескислородный | Кислородосодержащий | |
| Растворимый | окисление металла анода Me0 - ne→Men+ анод раствор | |
| Нерастворимый | Окисление анионов кроме фторидов Ас m-- me →Ас0 | В щелочной среде: 4ОН--4е→О2+2Н2О В кислой и нейтральной: 2Н2О-4е→О2 + 4Н + |
Анионы по их способности окисляться располагаются в следующем порядке   J-, Br-, S2- , Сl- , ОН- , SO42- , NO3- , F- J-, Br-, S2- , Сl- , ОН- , SO42- , NO3- , F- |
1.
Ход работы:
HHm
2. 








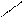

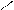
| |
| |
3. 

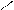
 Анод.
Анод.
4. 

 Катод.
Катод.
 | ||||||||||||||||
 | ||||||||||||||||
 |  |  | ||||||||||||||
| | ||||||||||||||||
 | ||||||||||||||||
 | ||||||||||||||||
 | ||||||||||||||||
Электролизный стакан.
1. Раствор электролита
2. Анод
3. Катод
Уравнение электролизного раствора CuSO4 с медным анодом.
A(+): Cu 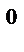 ‒ 2e→Cu
‒ 2e→Cu 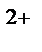
K(‒): Cu 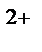 + 2e→Cu
+ 2e→Cu 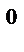 ↓ (масса катода увеличивается)
↓ (масса катода увеличивается)
Закон Фарадея
m 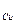
 =
= 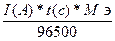
m = 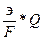
F - константа Фарадея= 96500 Кл.
Q – количество электричества прошедшего через систему.
Q = I(A) * t(c) = 1,1(A) * 1200(c) = 1320
m = 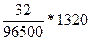 = 0,43
= 0,43
η = 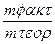 *100 = 90,9
*100 = 90,9
M 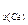 =
= 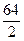 =32 г/моль.
=32 г/моль.
Схема процесса электролиза.

 |  | ||




|
|



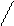
|











|
| J(A) | τ (c) | Масса катода (Cu) | mт (теор.) | mτ- mo (факт.) | η(Сu)% | |
| mo | mт | |||||
| 1,1 | 48,83 | 48,83 | 0,44 | 0,40 | 90,9 |
Вывод: Я изучил электродные процессы при электролизе растворов.
Контрольные вопросы.
1. В каких случаях образуются вторичные продукты при электролизе? Ответ: Вторичные продукты при электролизе образуются во всех случаях.
2. В какой последовательности и выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni2+, Cr2+,Fe3+?
Ответ: Cr2+, Fe3+, Ni2+
3. Какой силы должен быть ток, чтобы при пропускании его через расплав MgSO4 выделить на катоде 6 г. магния за 10 часов?
m 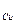
 =
= 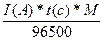
М 

 =
= 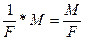
m = 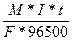 ; I=
; I= 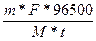
t = 3600с * 10 = 36000с
F = 2
M(Mg) = 24,305
m(Mg) = 6г.
I= 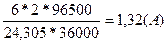
4. Через последовательно соединенные электролитические ванны с платиновыми электродами пропустили ток. В первой ванне раствор сульфата натрия, во второй - раствор нитрата серебра, а в третьей - раствор соляной кислоты. Какие продукты выделились на электродах во всех трех ваннах и сколько их получилось по массе, если в первой ванне выделится на катоде 1 мг. водорода?
K1: 2H2O + 2e = H2 + 2OH-
A1: 2H2O - 4e = O2 + 4H+
m(H 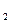 ) = 1мг.
) = 1мг.
m = 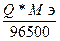
 ; Q =
; Q = 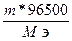
Мэ(Н 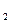 ) =
) = 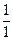 = 1
= 1
Q = 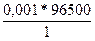 = 96,5 Кл
= 96,5 Кл
K2: Ag+ + e = Ag0
A2: 2H2O - 4e = O2 + 4H+
m = 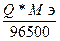
Мэ(Ag) = 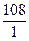 = 108
= 108
m(Ag) = 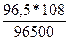 = 0,108г.
= 0,108г.
K3: 2H+ + 2e = H20
A3: 2Cl- - 2e = Cl20
Mэ(Cl) = 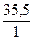 = 35,5
= 35,5
m(Cl) = 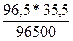 = 0,0355г.
= 0,0355г.
5. Через водный раствор NaCl (электроды угольные) пропускали ток сначала при перемешивании раствора, а затем без перемешивания, отделив в последнем вторичные продукты. Написать уравнения электродных процессов для двух случаев.
Решение для 1 случая.
К: 2H2O + 2e = H2 + 2OH
А: 2Cl - 2e = Cl2
Суммарное ионное ур-ие:
2H2O + 2Cl = H2 + Cl2 + 2OH
Суммарное молекулярное ур-ие:
2H2O + 2NaCl = H2 + Cl2 + 2NaOH
Решение для 2 случая.
K1: 2H2O + 2e = H2 + 2OH-
A1: 2H2O - 4e = O2 + 4H+
K2: Ag+ + 1e = Ag0
A2: 2H2O - 4e = O2 + 4H+
K3: 2H+ + 2e = H20
A3: 2Cl- - 2e = Cl20
