Теоретические основы работы. Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обозначаемое буквой К
Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обозначаемое буквой К, часто используется в различных термодинамических расчетах. Показатель К называют показателе адиабаты.
Значение К можно выразить через отношения массовых, объемных или мольных теплоемкостей:
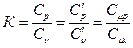 (1)
(1)
В молекулярно-кинетической теории газов для определения показателя адиабаты приводится следующая формула:
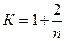 (2)
(2)
где п – число степеней свободы движения молекулы газа.
Для одноатомного газа п = 3, К = 1,667, для двухатомных газов п = 5, К = 1,4 и для трехатомных газов п = 6, К = 1,33.
Теплоемкости Ср и 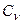 зависят от температуры, следовательно, и показатель адиабаты “К” должен зависеть от температуры. Установим эту зависимость следующим образцом:
зависят от температуры, следовательно, и показатель адиабаты “К” должен зависеть от температуры. Установим эту зависимость следующим образцом:
Используя уравнение Майера,
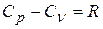 . (3)
. (3)
Запишем выражение, (1) в виде
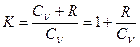 . (4)
. (4)
Для 1 моля газа получается
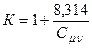 . (5)
. (5)
Обычно зависимость показателя адиабаты от температуры выражается формулой вида:
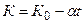 , (6)
, (6)
где К0 – значение показателя “К”при 00С ;
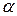 - коэффициент.
- коэффициент.
Для двухатомных газов при температурах до 20000С эмпирически получена следующая зависимость:
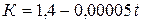 (7)
(7)
Изменение состояния термодинамической системы, происходящее без теплообмена с окружающей средой ( 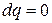 ) называется адиабатным процессом. Обратимый адиабатный процесс (
) называется адиабатным процессом. Обратимый адиабатный процесс ( 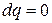 и
и 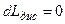 ) называется изоэнтропным процессом, т.е. процессом, в котором
) называется изоэнтропным процессом, т.е. процессом, в котором 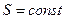 ,
, 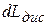 - диссилативные потери.
- диссилативные потери.
Из первого начала термодинамики следует, что для 1 кг закрытой термохимической гомогенной (однородной) системы, совершающей обратимый процесс, внешняя теплота.
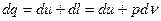 . (8)
. (8)
или используя известные выражения:
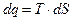 ;
; 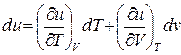 ;
;
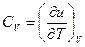
получим выражение:
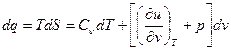 (9),
(9),
Но так как для атмосферного воздуха допустимы равенства
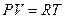 ,
, 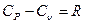 ;
; 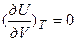 ,
,
совершенно точные лишь для идеального газа, то
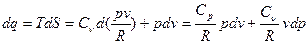 (10)
(10)
Так как в обратимых адиабатных термодинамических процессах
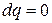 и
и 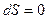 , то:
, то:
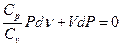 (11)
(11)
где 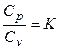 - введенный ранее показатель адиабаты.
- введенный ранее показатель адиабаты.
Разделив переменные и исключив P и V, при помощи равенства 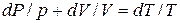 , являющегося дифференциальной формой уравнения Клайперона, получим три уравнения адиабаты:
, являющегося дифференциальной формой уравнения Клайперона, получим три уравнения адиабаты:
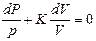 ;
; 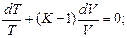
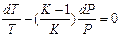 (12)
(12)
В интегральной форме при (  ) они принимают вид:
) они принимают вид:
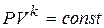 ;
; 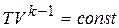 ;
; 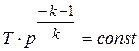
Следовательно, показатель адиабатного процесса может быть выражен также и равенствами
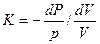 ;
; 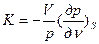 (13)
(13)
В идеальном изотермическом процессе 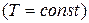 ,
,
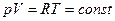 и
и 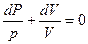 или
или 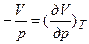 (14)
(14)
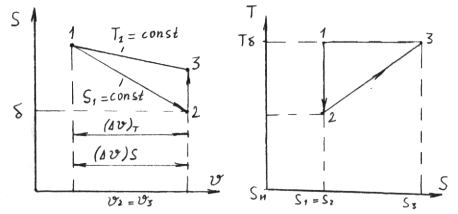
Поэтому, если через определенную точку с параметрами 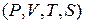 в
в 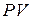 и
и 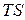 - осях (рис.1 ) процессы
- осях (рис.1 ) процессы 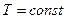 и
и 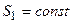 , то в состоянии I отношении
, то в состоянии I отношении 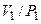 или
или 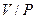 , входящее в уравнение (13) и (14), будет одно и то же.
, входящее в уравнение (13) и (14), будет одно и то же.
Тогда величина:
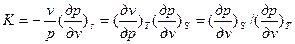 (15)
(15)
Таким образом, для определения истинного показателя адиабаты необходимы аналитически или экспериментально установленные значения калорических ( 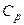 ,
, 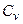 ) или же термических параметров (P, V, T), а также их частных дифференциалов и производных.
) или же термических параметров (P, V, T), а также их частных дифференциалов и производных.
Рис.1
Но если в уравнение (15) подставить малые конечные приращения, то при 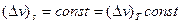 средний показатель адиабаты
средний показатель адиабаты
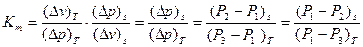
а при Р = Рб, т.е. равном барометрическому давлению.
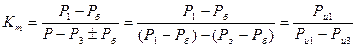 (16)
(16)
При уменьшении избыточного давления Ри1 средний показатель адиабаты 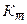 будет приближаться к истинному К, присущему атмосферному воздуху.
будет приближаться к истинному К, присущему атмосферному воздуху.
Определив средний показатель адиабаты и используя равенство:
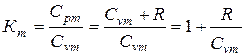 (17)
(17)
можно вычислить, 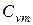 и
и 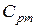 , а затем известных
, а затем известных 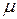 и
и 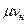 найти
найти 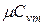 ,
, 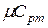 ,
, 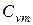 и
и 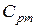 , т.е. определить средние изохорные и изобарные весовые, мольные и объемные теплоемкости воздуха.
, т.е. определить средние изохорные и изобарные весовые, мольные и объемные теплоемкости воздуха.
