При електролізі однакові кількості електрики виділяють на електродах еквівалентні маси речовин.
Наслідок з цього закону: щоб виділити на електроді один моль еквівалентів будь-якої речовини, треба витратити одну і ту кількість електрики (96500 кулонів). Це число називають числом Фарадея (F= 96500 кул).
Математичне рівняння, що узагальнює закони Фарадея має вигляд:
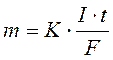
ПАСПОРТ РОБОТИ
| 1.Розчин йодиду калію. 2.Розчин броміду калію. 3.Розчин хлориду калію. 4.Розчин броміду натрію. 5.Розчин сульфату міді. 6.Розчин сульфату свинцю | 7.Розчин сульфату цинку. 8.Розчин сульфату нікелю. 9.Розчин фенолфталеїну (спиртовий). 10.Клейстер з крохмалю. 11.Штатив з пробірками. 12.Електролізер з графітовими електродами. |
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Техніка безпеки.
При виконанні роботи необхідно пам’ятати, що ви працюєте з струмом. Тому не забудьте після досліду вимикати струм, а також по закінченню всієї роботи.
Електроліз йде із застосуванням постійного електричного струму.
Електролізер складається з U-подібної трубки висотою 15-20 см (див. малюнок). Електродами є графітові стержні.
У всіх дослідах електролізер заповнюється розчином електроліту на 2/3 за об’ємом. Перед початком кожного досліду електролізер і електроди миють дистильованою водою.
Дослід 1. Електроліз водних розчинів солей, що відбувається з окисленням на аноді кислотних залишків.
Спостерігайте забарвленість розчинів біля електродів. Скласти рівняння електродних процесів. Визначити реакцію середовища біля катоду і аноду.
Робоче місце № 1. Електроліз розчину йодиду калію.
До розчину біля катоду додайте 2-3 краплини фенол-фталеїну; до розчину біля аноду – 2-3 краплі крохмального клейстеру.
Робоче місце № 2. Електроліз розчину броміду калію.
До розчину біля катоду додайте 2-3 краплини фенол-фталеїну.
Робоче місце № 3. Електроліз розчину хлориду кальцію.
До розчину біля катоду додайте 2-3 краплини фенол-фталеїну.
Робоче місце № 4. Електроліз розчину фториду натрію.
До розчину біля катоду додайте 2-3 краплини фенол-фталеїну.
Дослід 2. Електроліз водних розчинів солей, який йде з відновленням і окисленням води.
Спостерігайте виділення газів біля електродів. Скласти рівняння електродних процесів.
Робоче місце № 1. Електроліз водного розчину сульфату натрію.
Робоче місце № 2. Електроліз водного розчину сульфату магнію.
Робоче місце № 3. Електроліз водного розчину нітрату калію.
Робоче місце № 4. Електроліз водного розчину карбонату натрію.
Дослід 3. Електроліз водних розчинів солей, який йде з виділенням металів на катоді (метали на катоді зберігати до наступного досліду).
Спостерігайте виділення металу на катоді. Скласти рівняння електродних процесів.
Робоче місце № 1. Електроліз водного розчину сульфату міді.
Робоче місце № 2. Електроліз водного розчину сульфату цинку.
Робоче місце № 3. Електроліз водного розчину нітрату свинцю.
Робоче місце № 4. Електроліз водного розчину сульфату нікелю.
Дослід 4. Електроліз водних розчинів солей з розчинним анодом.
Після проведення досліду 3 поміняйте місцями клейми на електролізері і підключить до електричної мережі.
Спостерігайте розчинення шару металу на аноді, тобто окислення на аноді і перехід металу на катод. Скласти рівняння електродних процесів.
Лабораторна робота №15.
