Индикаторы окислительно-восстановительного титрования
При окислительно-восстановительном титровании используют индикаторы, изменение окраски которых зависит от окислительно-восстановительного потенциала. Такие индикаторы называют редокс-индикаторами или окислительно-восстановительными индикаторами. Они представляют собой окислительно-восстановительные системы, изменяющие окраску при переходе окисленной формы в восстановленную и наоборот.
Если обозначить окисленную форму индикатора Ind окисл., восстановленную форму Ind восст., а число передаваемых электронов n, то превращение одной формы такого индикатора в другую можно изобразить схемой:
Ind окисл. + n e ® Ind восст.
Применяя к данной системе уравнение Нернста, получим:
Е = Ео + 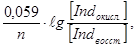 где
где
Ео – стандартный окислительно-восстановительный потенциал данной пары, который отвечает равенству [Ind окисл.] = [Ind восст.].
Например, значение стандартного окислительно-восстановительного потенциала для индикатора дифениламина NH(C6H5)2, который используется при дихроматометрическом титровании, равно 0,76 В. Область перехода дифениламина лежит в пределах от 0,73 В до 0,79 В. При потенциалах, меньших 0,73 В, преобладает восстановленная форма индикатора и раствор, остается бесцветным. При потенциалах, больших 0,79 В преобладает окисленная форма индикатора и раствор приобретает интенсивную сине-фиолетовую окраску.
Окислительно-восстановительное титрование может проводиться и без участия индикатора, если окраска раствора титранта достаточно резко изменяется в результате реакции. Подобное безиндикаторное титрование возможно при использовании в качестве титранта раствора перманганата калия КМпО4 в кислой среде. Малиново-фиолетовая окраска ионов МпО4-- при этом исчезает в результате восстановления их до бесцветных катионов Мп2+. Когда весь восстановитель будет оттитрован, одна лишняя капля перманганата калия окрасит весь раствор в розовый цвет.
Также без индикатора можно титровать восстановители раствором иода, так как его характерная темно-бурая окраска исчезает в результате восстановления I2 в ионы I-. Однако, окраска раствора иода не очень интенсивна, поэтому удобнее пользоваться в этом случае таким индикатором, как раствор крахмала, дающий интенсивную синюю окраску даже с очень небольшим количеством свободного иода.
Перманганатометрическое титрование
Сущность метода
Перманганатометрическое титрование (перманганатометрия) основано на применении в качестве титранта раствора перманганата калия КМпО4, который является сильным окислителем. Перманганатометрия имеет ряд особенностей. Во-первых, продукты восстановления перманганата калия зависит от характера среды раствора (рН):


 + 5 е Мп2+(МпSO4); МЭк(КМпО4) =
+ 5 е Мп2+(МпSO4); МЭк(КМпО4) = 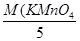

кислая среда бесцветный
(рН<7) раствор


 КМп7+О4 + 3 е Мп4+(МпО2¯); МЭк(КМпО4) =
КМп7+О4 + 3 е Мп4+(МпО2¯); МЭк(КМпО4) = 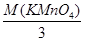
Малиново- нейтральная бурый осадок
фиол. р-р среда (рН=7)
 +1 е Мп6+(К2МпО4); МЭк(КМпО4) =
+1 е Мп6+(К2МпО4); МЭк(КМпО4) = 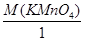
щелочная среда зеленый раствор
(рН>7)
Наиболее благоприятной средой для проявления окислительных свойств КМпО4 является кислая среда (Ео= 1,151 В).
Во-вторых, данный метод является безиндикаторным. После того,как весь восстановитель оттитрован, добавление небольшого избыточного количества окислителя вызывает появление бледно-розовой окраски раствора.
Приготовить титрованный раствор перманганата калия путем растворения точной навески нельзя. Это связано с тем, что перманганат калия содержит примеси и концентрация первоначально приготовленного раствора через некоторое время заметно понижается, так как он частично расходуется на взаимодействие с восстановителями (аммиаком, органическими веществами), присутствующими в воде. Поэтому молярную концентрацию эквивалента раствора перманганата калия устанавливают обычно на 5 – 7 день после приготовления, когда все внутренние окислительные процессы в нем уже завершаются. Стандартизацию раствора КМпО4, как правило, производят по щавелевой кислоте.
Лабораторная работа 11
