Задачи и упражнения для самостоятельного решения. 23.1. Закончить уравнения реакций: а) K2Cr2O7 + KI + H2SO4 = ;
23.1. Закончить уравнения реакций: а) K2Cr2O7 + KI + H2SO4 = …;
б) CrO3 + NaOH = …; в) CrCl3 + H2O ↔ …; г) Cr2O3 + H2SO4 =….
23.2. Вычислить тепловой эффект реакции получения хрома по стандартным энтальпиям образования: Cr2O3 + 2Al = Al2O3 + 2Cr.
( 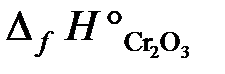 = –1440,6 кДж/моль;
= –1440,6 кДж/моль; 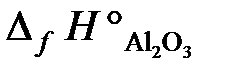 = –1676 кДж/моль).
= –1676 кДж/моль).
(Ответ: –235,4 кДж).
23.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → CrCl3.
23.4. Закончить уравнения реакций: а) NaCrO2 + PbO2 + NaOH = …;
б) K2Cr2O7 + FeSO4 + H2SO4 = …; в) Cr2(SO4)3 + H2O ↔ ….
23.5. Какой объем хлора при нормальных условиях выделится при взаимодействии одного моля дихромата натрия с избытком соляной кислоты?
(Ответ: 67,2 л).
23.6. Составить уравнения реакций взаимодействия в щелочной среде хлорида хрома (III): а) с бромом (Br2); б) с пероксидом водорода (H2O2).
23.7. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6].
23.8. Можно ли восстановить хром из его оксида алюминием? Ответ мотивировать, вычислив ΔG° реакции: Cr2O3 + 2Al = Al2O3 + 2Cr.
( 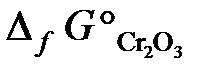 = –1050 кДж/моль;
= –1050 кДж/моль; 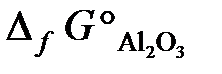 = –1582 кДж/моль).
= –1582 кДж/моль).
23.9. Составить уравнения реакций взаимодействия в щелочной среде сульфата хрома (III): а) с бромом (Br2); б) с диоксидом свинца (PbO2).
23.10. Учитывая, что координационное число хрома (III) равно 6, написать уравнения реакций образования комплексных соединений хрома и назвать их: а) CrCl3 + KCN (избыток) = …; б) Cr(OH)3 + NaOH (избыток) = …;
в) CrCl3 + NH4OH (избыток) = ….
23.11. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей хрома: а) Cr2(SO4)3 + K2CO3 + H2O = …;
б) Cr(NO3)3 + H2O ↔ …; в) CrCl3 + Na2S + H2O = ….
23.12. Вычислить молярную массу эквивалентов и эквивалент восстановителя в реакции
2СrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O.
23.13. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают степени окисления +6 и +3. Составить уравнение реакции.
23.14. Можно ли получить хром восстановлением Cr2O3 водородом с образованием водяного пара при стандартном состоянии всех веществ? Ответ обосновать, рассчитав ΔG° реакции
Cr2O3 + 3Н2 = 3Н2O (г) + 2Cr.
( 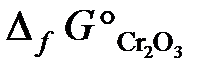 = –1050 кДж/моль;
= –1050 кДж/моль; 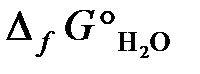 = –228,6 кДж/моль).
= –228,6 кДж/моль).
23.15. Закончить уравнения реакций: а) Na2CrO4 + H2SO4 = …;
б) Na2Cr2O7 + NaOH = …; в) Na2Cr2O7 + HCl = …; г) Cr + HCl = ….
23.16. Закончить уравнения реакций окисления соединений хрома (III):
а) Cr2O3 + NaNO3 + Na2CO3  …; б) Cr(NO3)3 + NaBiO3+ HNO3 = ….
…; б) Cr(NO3)3 + NaBiO3+ HNO3 = ….
23.17. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции
2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
23.18. Закончить уравнения реакций:
а) Cr2O3 + H2SO4 = …; б) Cr2O3 + КОН  …;
…;
в) Cr2O3 + КОН + KMnO4 = …
23.19. Предложить 4 способа получения Cr2O3 Составить соответствующие уравнения реакций.
23.20. Какая масса дихромата калия требуется для приготовления 2 л 0,1 н. (по отношению к реакциям окисления в кислой среде) раствора K2Cr2O7?
(Ответ: 9,8 г).
Марганец
Теоретическое введение
Марганец является элементом побочной подгруппы VII группы. Это
d-металл. Электронная структура внешнего энергетического уровня его атома выражается формулой 3d54s2. Типичные степени окисления марганца +2, +4, +7, менее свойственные +3, +6. Для химии марганца очень характерны окислительно-восстановительные реакции. При этом в кислой среде для марганца устойчива степень окисления +2, в сильнощелочной +6, в нейтральной +4.
В соответствии с возможными степенями окисления марганец образует оксиды: Mn+2O, Mn2+3O3, Mn+4O2, Mn+6O3, Mn2+7O7
С повышением степени окисления марганца ослабевают основные и усиливаются кислотные свойства оксидов и гидроксидов. MnO и Mn2O3 и соответствующие им гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер. Нерастворимый в водеMn(OH)2 на воздухе вследствие окисления кислородом постепенно переходит в бурыйMn(OH)3:
4Mn(OH)2 + O2 + 2H2O = 4Mn(OH)3
Окончательным продуктом окисления является коричневый оксид-гидроксид марганца:
4Mn(OH)3 + O2 + 2H2O = 4Mn(OH)4 = 4MnO(OH)2 + 4H2O
Соли марганца (II) и их концентрированные растворы обычно окрашены в светло-розовый цвет. Соединения марганца (II) – восстановители.
Оксид марганца (IV)MnO2 – темно-бурое нерастворимое в воде вещество, наиболее устойчивое кислородное соединение марганца при обычных условиях. Обладает слабо выраженными амфотерными свойствами. С концентрированной H2SO4 он дает крайне неустойчивую соль Mn(SO4)2, а при сплавлении со щелочами образует манганиты:
MnO2 + 2KOH = K2MnO3 + H2O.
MnO2 − сильный окислитель, при этом он восстанавливается до солей марганца (II): MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Действием более сильных окислителей MnO2 может быть окислен до соединений Mn (VI), Mn (VII):
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O.
K2MnO4 − манганат калия, соль не выделенной в свободном состоянии марганцовистой кислоты H2MnO4. Не получен и оксид Mn (VI) – MnO3. Растворы манганатов окрашены в темно-зеленый цвет, присущий ионам MnO42−. Они устойчивы только в сильнощелочной среде, при разбавлении раствора водой манганаты диспропорционируют:
3K2MnO4 + 2H2O = 2КMnO4 + MnO2 + 4KOH.
Все производные Mn (VI)являются окислителями, особенно в кислой среде. Однако при действии более сильных окислителей они превращаются в соединения марганца (VII):
K2MnO4 + Сl2 = 2КMnO4 + 2KCl.
Оксид марганца (VII) Mn2O7 – зеленовато-черная жидкость, сильный окислитель. Растворим в воде. Отвечающая ему марганцовая кислота HMnO4 известна только в растворах. Эти растворы, а также растворы ее солей (перманганаты), окрашены в фиолетово-малиновый цвет, характерный для иона (MnO4)−. При нагревании перманганаты разлагаются с выделением кислорода:
2КMnO4 = K2MnO4 + MnO2 + O2.
Производные Mn (VII) – сильные окислители. В кислой среде они восстанавливаются до солей марганца (II), в нейтральной, а также в слабокислой и слабощелочной – до MnO2, в сильнощелочной до манганатов, которые затем постепенно переходят в соединения Mn (IV).
