Составить ионно-молекулярное молекулярное уравнения гидролиза хлорида железа (III). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе.
|
РЕШЕНИЕ:
FeCl3 диссоциирует в растворе:
FeCl3 → Fe3+ + 3Cl-
 FeCl3
FeCl3
Fe(OH)3 + H2SO4
cлаб. cильн.
Сокращенное ионно-молекулярное уравнение гидролиза:
|
|
Fe3+ + НОН <=> + , рН<7, среда
кислая
Молекулярное уравнение гидролиза:
FeCl3 + H2O <=> FeOHCl2 + HCl

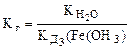 ,
,
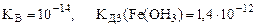 (табл.)
(табл.)

 ;
;  =0,84
=0,84
pН= -1/2∙lgKг-1/2∙lg  =
=
= 


Ответ: 
2. Используя справочные данные по 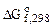 и
и 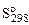 веществ определить равновесное парциальное давление СО при температуре 1000 К для реакции:
веществ определить равновесное парциальное давление СО при температуре 1000 К для реакции:
Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г).
 | РЕШЕНИЕ: Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г).  р р  |
-2,3RTlgKp = 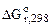 – T
– T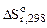
Значения 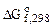 и
и 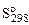 веществ берем из табл.
веществ берем из табл.
| Fe3O4(к)+ | 4C(к) = | 3Fe(к) + | 4CO(г) | |
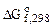 , кДж/моль , кДж/моль | -1117,1 | 4(-110,5) | ||
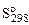 , Дж/моль·К , Дж/моль·К | 146,2 | 4·5,7 | 3·27,15 | 4·197,5 |
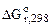 =[4
=[4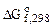 (CO(г)) + 3
(CO(г)) + 3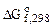 (Fe(к))]-
(Fe(к))]-
-[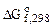 (Fe3O4(к)) + 4
(Fe3O4(к)) + 4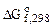 (C(к))]
(C(к))]
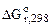 = 4(-110,5) – (-1117,1) = 675,1 кДж.
= 4(-110,5) – (-1117,1) = 675,1 кДж.
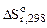 = [4
= [4 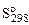 (CO(г)) + 3
(CO(г)) + 3 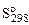 (Fe(к))] –
(Fe(к))] –
-[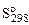 (Fe3O4(к))+ 4
(Fe3O4(к))+ 4 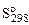 (C(к))]
(C(к))]
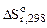 = [4·197,5 + 3∙27,15] – [146,2 + 4·5,7] = 702,45 Дж/К
= [4·197,5 + 3∙27,15] – [146,2 + 4·5,7] = 702,45 Дж/К
Kp = 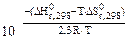
Kp = 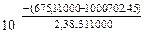 = 26,9
= 26,9
р  = 26,9
= 26,9
рCO = 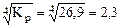 атм.
атм.
Ответ: рCO = 2,3 атм.
3. При растворении 6 г сплава меди, железа и алюминия в хлороводородной кислоте выделилось 3 л водорода (н.у.) и получено 1,86 г нерастворившегося осадка (н.о.). Определить состав сплава (%мас.).
|
РЕШЕНИЕ:
ωме =  ∙ 100%
∙ 100%
 |
В хлороводородной кислоте растворяются железо и алюминий согласно следующим уравнениям реакций:
Fe + 2HCl = FeCl2 + H2 (17.4)
2Al + 6HCl = 2AlCl3 + 3H2 (17.5)
Медь в этих условиях не растворяется, следовательно:
mн.о. = mCu = 1,86 г
mFe+Al = mспл – mCu= 6 – 1,86 = 4,14 г
Пусть х – масса железа в сплаве, г;
Fe - H2 (реакция 17.4)
56 г Fe - 22,4 л Н2
m г Fe - V 
V  =
=  , л
, л
Тогда (4,14 – х) - масса алюминия в сплаве, г;
2 Al → 3H2 (реакция 17.5)
2∙27 г Al - 3·22,4 л Н2
(4,14 – х) г Al - V 
V  =
= 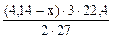 , л
, л
Суммарный объем выделившегося водорода:
V  + V
+ V  =
=  +
+ 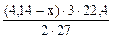 = 3 л
= 3 л
m = 2,56 г
Следовательно  = 2,56 г,
= 2,56 г, 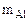 = 4,14 – 2,56 = 1,58 г
= 4,14 – 2,56 = 1,58 г
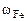 =
= 
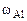 =
= 
 =
= 
Ответ: состав сплава: 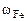 = 43%мас.,
= 43%мас., 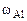 = 26%мас.,
= 26%мас.,
 = 31%мас.
= 31%мас.
П. 1 Индивидуальные домашние задания.
| № ндивиду-ального домашнего задания | Номера задач каждой главы. | № индивидуаль-ного домашнеего задания. | Номер задач каждой главы. | ||
П. 2 ОСНОВНЫЕ ВОПРОСЫ КУРСА ХИМИИ
РК-1
(I семестр)
Блок
1. Закон сохранения массы-энергии. Закон Авогадро. Атомные и молярные массы. Моль.
2. Методы определения молярных масс газообразных веществ. Парциальное давление газа. Закон Дальтона.
3. Оксиды: классификация, номенклатура, свойства.
4. Кислоты: классификация, номенклатура, свойства.
5. Основания: классификация, номенклатура, свойства.
6. Соли: классификация, номенклатура, свойства.
7. Эквивалент, закон эквивалентов. Расчет молярных масс эквивалентов простых и сложных веществ.
8. Растворы. Способы выражения состава растворов: молярная концентрация; эквивалентная концентрация растворенного вещества, моляльность.
9. Массовая и молярная доля растворенного вещества, титр раствора вещества. Плотность раствора.
10. Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия.
11. Изобарный тепловой эффект химической реакции. Энтальпия. Стандартные энтальпии образования, сгорания и растворения химических веществ.
12. I и II закон термохимии, I и II следствия из закона Гесса.
13. Энтропия. Стандартная энтропия химических соединений. Расчет изменения энтропии химических реакций.
14. Энергия Гиббса. Стандартная энергия Гиббса образования химических соединений. Расчет изменения энергии Гиббса химических реакций.
15. Энергия Гиббса и направленность протекания химических реакций.
II блок
1. Скорость химических реакций. Средняя и истинная скорость реакций. Зависимость скорости реакции от концентрации реагирующих веществ.
2. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
3. Скорость химических реакций в гетерогенных системах. Катализ.
4. Химическое равновесие. Выражение константы равновесия для гомогенных и гетерогенных систем. Константа равновесия и ее связь с термодинамическими функциями.
5. Принцип Ле Шателье.
6. Физические и химические свойства воды. Диаграмма состояния воды.
7. Законы Рауля и Вант-Гоффа для растворов неэлектролитов.
8. Основы теории электролитической диссоциации. Степень и константа диссоциации. Сильные и cлабые электролиты.
9. Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
10. Ионное произведение воды, рН растворов. Произведение растворимости.
11. Ионно-молекулярные уравнения. Основные случаи гидролиза однозарядных ионов.
12. Гидролиз многозарядных ионов. Усиление и ослабление процесса гидролиза.
13. Константа, степень и рН гидролиза.
III блок
1. Реакции окисления-восстановления. Типичные окислители и восстановители.

 0.01M Kг - ? pH- ? h - ?
0.01M Kг - ? pH- ? h - ?  - ?
- ?  = 3 л mн.о.=1,86 г %ωFe - ? %ωAl - ? %ωCu - ?
= 3 л mн.о.=1,86 г %ωFe - ? %ωAl - ? %ωCu - ?