ЧАСТЬ II. ОМЫЛЕНИЕ СЛОЖНЫХ ЭФИРОВ В ПРИСУТСТВИИ
ЩЁЛОЧИ
Для выполнения этой части работы, в две мерные колбочки на 100 мл, предварительно вымытые и высушенные, наливают по 50 мл раствора: в первую 0,01нраствор сложного эфира (метил или этилацетата), во вторую 1/60 нраствор едкого натра. Эти колбочки закрывают пробкой и устанавливают в термостате с температурой 250С.
Через 10-15 мин. раствор эфира выливается в раствор щелочи, причем колбочку со щелочью не вынимают из термостата.
Через 10 минут отбирают пробу в количестве 10 мл в коническую колбу, в которую заранее наливают 10 мл воды и помещают в кристаллизатор со льдом. Отобранная проба титруется кислотой с индикатором метиловым оранжевым.
Затем последовательно через промежутки времени 20, 40, 70, 100минут (от начала реакции) отбирают другие пробы по 10 мл и титруют кислотой одной и той же концентрации. Реакция омыления сложного эфира щёлочью практически заканчивается через 10-12 часов.
Пусть n0 мл – количество кислоты, которое пошло на титрование 5 мл исходной щелочи в 15 мл воды. Пусть по времени t на титрование пробы смеси потребуется nt мл кислоты. Для времени, когда реакция практически полностью доходит до конца, количество кислоты затраченной на титрование, будет n¥ мл.
Если нормальность кислоты, взятой для титрования N, то в начале реакции во взятом для титрования объёме V (мл) содержит: n0 × N миллиграмм-эквивалентов щёлочи (миллиграмм-эквивалент/мл = грамм-эквивалент). Ко времени t количество щёлочи, нейтрализованное кислотой, определяется как nt × N миллиграмм-эквивалентов щёлочи. Если щелочь в избытке, как в нашем случае, то количество сложного эфира, подвергающееся омылению, определится как разность между мг-эквивалент щелочи, нейтрализованной кислотой, а именно (n0 - n¥).
Следовательно, ко времени t мы получим следующие количества реагирующих веществ:
- для щелочи: (а – х) = nt × N,
- для сложного эфира: (в – х) = (n0 – n¥) × N – (n0 – nt) × N = N × (nt - n¥),
- для начального количества щелочи: а = n0 × N,
- для начального количества сложного эфира: в = (n0 - n¥) × N, (а – в) = n¥ × N
Если полученные выражения подставить в уравнение (11), то константа скорости реакции для случая, когда в исходной смеси имеется избыток щелочи, определится следующим выражением:
(12)
где V – объем взятой пробы,
N – нормальность кислоты взятой для титрования.
Вода, которая используется при титровании, не должна содержать растворенный углекислый газ, который уделяется кипячением воды в течение часа.
Полученные данные и результаты расчета рекомендуется записывать в виде таблицы:
Из полученных значений констант скоростей омыления эфира находят среднее значение.
| Лабораторная работа № 11 Омыление сложных эфиров в присутствии кислой и щелочной среды | |
| - для начального количества сложного эфира: в = (n0 - n¥) × N, (а – в) = n¥ × N Если полученные выражения подставить в уравнение (11), то константа скорости реакции для случая, когда в исходной смеси имеется избыток щелочи, определится следующим выражением: 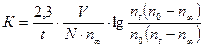 (12) (12)
где V – объем взятой пробы, N – нормальность кислоты взятой для титрования. Вода, которая используется при титровании, не должна содержать растворенный углекислый газ, который уделяется кипячением воды в течение часа. Полученные данные и результаты расчета рекомендуется записывать в виде таблицы: | t мин | nt | nt - n¥ | 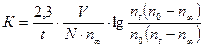 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | Из полученных значений констант скоростей омыления эфира находят среднее значение. | |
| 100 мл, предварительно вымытые и высушенные, наливают по 50 мл раствора: в первую 0,01н раствор сложного эфира (метил или этилацетата), во вторую 1/60 н раствор едкого натра. Эти колбочки закрывают пробкой и устанавливают в термостате с температурой 250С. Через 10-15 мин. раствор эфира выливается в раствор щелочи, причем колбочку со щелочью не вынимают из термостата. Через 10 минут отбирают пробу в количестве 10 мл в коническую колбу, в которую заранее наливают 10 мл воды и помещают в кристаллизатор со льдом. Отобранная проба титруется кислотой с индикатором метиловым оранжевым. Затем последовательно через промежутки времени 20, 40, 70, 100минут (от начала реакции) отбирают другие пробы по 10 мл и титруют кислотой одной и той же концентрации. Реакция омыления сложного эфира щёлочью практически заканчивается через 10-12 часов. Пусть n0 мл – количество кислоты, которое пошло на титрование 5 мл исходной щелочи в 15 мл воды. Пусть по времени t на титрование пробы смеси потребуется nt мл кислоты. Для времени, когда реакция практически полностью доходит до конца, количество кислоты затраченной на титрование, будет n¥ мл. Если нормальность кислоты, взятой для титрования N, то в начале реакции во взятом для титрования объёме V (мл) содержит: n0 × N миллиграмм-эквивалентов щёлочи (миллиграмм-эквивалент/мл = грамм-эквивалент). Ко времени t количество щёлочи, нейтрализованное кислотой, определяется как nt × N миллиграмм-эквивалентов щёлочи. Если щелочь в избытке, как в нашем случае, то количество сложного эфира, подвергающееся омылению, определится как разность между мг-эквивалент щелочи, нейтрализованной кислотой, а именно (n0 - n¥). Следовательно, ко времени t мы получим следующие количества реагирующих веществ: - для щелочи: (а – х) = nt × N, - для сложного эфира: (в – х) = (n0 – n¥) × N – (n0 – nt) × N = N × (nt - n¥), - для начального количества щелочи: а = n0 × N, | |
| Омыление сложных эфиров в присутствии кислой и щелочной среды Приборы и материалы 1. Термостат 2. Часы или секундомер 3. 0,1 н раствор HCl 4. 1/60 н раствор NaOH 5. Дистиллированная вода 6. Охлаждающая смесь (лед) 7. Этилацетат и раствор этилацетата в воде (для щелочной среды) 8. Набор конических колб на 100 мл для титрования – 4 шт. 9. Набор мерных колб на 100 мл – 3 шт. 10. Индикаторы (фенолфталеин, метилоранж) 11. Кристаллизатор 12. Пипетки – 2, 5, 10 мл КРАТКАЯ ТЕОРИЯ Реакции первого порядка Мономолекулярными реакциями называют такие реакции, в которых только один Определение среднего значения константы скорости реакции омыления сложного эфира (например, метил- или этилацетата) водой: RCOOR' + Н3О ——> RCOO- + Н+- + R'OH Реакции омыления сложных эфиров в присутствии ионов водорода. В разбавленных эфирных растворах вследствие большого избытка воды омыление протекает практически полностью, но крайне медленно. Поскольку ионы Н+ катализируют процесс, для проведения реакции в приемлемом для работы промежутке времени ее проводят в кислой среде. Так как в результате самой реакции | |
акций первого порядка как начальная концентрация, так изменение концентрации исходного вещества во время реакции могут быть заменены пропорциональными величинами, например, при инверсии тростникового сахара изменению угла вращения реакционной смеси. Расчет константы скорости гидролиза сложного эфира производится по уравнению (11). Результат титрования и расчетов рекомендуется сводить в таблицу следующего вида: Таблица1 | t, мин | nt | Dt = nt - no | D¥ - Dt = n¥ - nt | 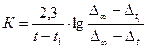 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | неделя | | | | | Из полученных значений К находят среднее значение. В тех случаях, когда трудно провести титрование в момент времени t0 любой отсчет времени может быть принят за нулевой. Например, первое титрование можно проводить через 3-10 мин. от начала реакции, но тогда расчет константы скорости реакции гидролиза сложного эфира следует производить по уравнению: 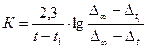
где t1 – время первого титрования. ЧАСТЬ II. ОМЫЛЕНИЕ СЛОЖНЫХ ЭФИРОВ В ПРИСУТСТВИИ ЩЁЛОЧИ Для выполнения этой части работы, в две мерные колбочки на | |
образуется кислота, то омыление является автокаталитическим процессом, что усложняет течение реакции. Однако если начальная концентрация ионов Н+ велика, то увеличение концентрации кислоты будет относительно небольшим. Поэтому реакцию проводят в присутствии значительного количества сильной кислоты (например, НС1). При большом избытке воды скорость омыления будет зависеть только от концентрации эфира, т. е. реакция будет первого порядка. Поэтому скорость ее определяется по уравнению (1), т. е. 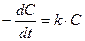 (1), интегрируя которое получим: (1), интегрируя которое получим: 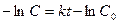 (2) или (2) или 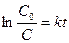 (3), откуда: (3), откуда: 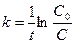 (4) – уравнение для константы скорости I-го порядка, {t-1}. где С0 - начальная концентрация эфира; С - концентрация эфира в данный момент времени t. В общем виде реакцию гидролиза эфира можно представить уравнением: RA + H2O = ROH + HA, гдеRA – сложный эфир; ROH – образующийся спирт; HA – образующаяся кислота. Скорость гидролиза, протекающего как реакция первого порядка, выразится уравнением: (4) – уравнение для константы скорости I-го порядка, {t-1}. где С0 - начальная концентрация эфира; С - концентрация эфира в данный момент времени t. В общем виде реакцию гидролиза эфира можно представить уравнением: RA + H2O = ROH + HA, гдеRA – сложный эфир; ROH – образующийся спирт; HA – образующаяся кислота. Скорость гидролиза, протекающего как реакция первого порядка, выразится уравнением: 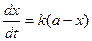 , (5) где х – количество разложившегося сложного эфира; а – первоначальное количество сложного эфира. Интегрируя последнее уравнение, получим выражение для константы скорости гидролиза сложного эфира: , (5) где х – количество разложившегося сложного эфира; а – первоначальное количество сложного эфира. Интегрируя последнее уравнение, получим выражение для константы скорости гидролиза сложного эфира: 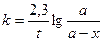 (6) (6) | |
быть такой же, как при предыдущих титрованиях). Для заключительного титрования отбирают две пробы реакционной смеси по 3 мл, которые титруют, как описано выше. Так как по мере течения реакции количество кислоты непрерывно увеличивается, то о скорости процесса судят по увеличению количества раствора щелочи, идущего на титрование проб реагирующей смеси. Обозначим через no мл количество щелочи, которое потребовалось при первоначальном титровании, т. е. для времени t = 0, а через n1, n2, n3, n4, мл – количества щелочи, которые потребовались на титрование таких же по величине проб реакционной смеси при последующих опытах, т.е. для времени, равного соответственно: t1, t2, t3, t4. Количество щелочи, которое пошло на титрование смеси в заключительном опыте (при t=¥), обозначим n¥. Разность между количеством щелочи, пошедшей на титрование в каждый момент времени (t1, t2, t3, t4) и количеством щелочи, пошедшей на титрование в момент времени t = 0, обозначим D1 = n1 – n0; D2 = n2 – n0 и т. д. Тогда количество сложного эфира, подвергшегося гидролизу х1, х2, х3, x4 … х¥ по времени t1, t2, t3, t4, t¥, соответственно, будет пропорционально значениям D1, D2, D3, D4 … D¥, в общем Dt. Очевидно, что начальное количество сложного эфира будет пропорционально D¥ = n¥ - nо, и отношение в последнем уравнении будет равно: 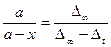 /10/. В этом случае константа скорости гидролиза сложного эфира выразится следующим образом: /10/. В этом случае константа скорости гидролиза сложного эфира выразится следующим образом: 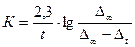 /11/. Как видно из уравнений (10) и (11) титр применяемой щелочи не нужен для расчета и может даже быть не известен, если для всех определений применять раствор щелочи постоянной концентрации. Следует отметить, что при вычислении констант скоростей ре /11/. Как видно из уравнений (10) и (11) титр применяемой щелочи не нужен для расчета и может даже быть не известен, если для всех определений применять раствор щелочи постоянной концентрации. Следует отметить, что при вычислении констант скоростей ре | |
Реакции второго порядка Бимолекулярными реакциями называются такие реакции, в которых принимают участие два различных вида молекул или две молекулы одного вида, т.е. реакции, в которых сумма показателей степеней в кинетическом уравнении равна двум. К реакциям второго порядка могут быть отнесены химические процессы, в которых стехиометрический коэффициент исходных продуктов больше двух, но в виду того, что кинетика этих процессов описывается уравнениями бимолекулярных реакций, такие процессы относятся к реакциям второго порядка. Очень часто действительное протекание реакций не отражается схемой, соответствующей стехиометрическому уравнению. Нередко обнаруживается, что реакции (в особенности более сложные) протекают в несколько стадий, из которых каждая описывается более простой схемой, чем суммарная реакция. Экспериментальному измерению поддается только наиболее медленная из всех реакций, и она является определяющей для общей скорости процесса и порядка реакции. Для того чтобы произошла бимолекулярная реакция, необходимо столкновение двух разнородных или одинаковых молекул. Поэтому для скорости бимолекулярной реакции определяющим фактором является не только реакционная способность / в данном случае реакционной способностью надо понимать избыточную энергию, которой должны обладать молекулы, чтобы при их столкновении произошла реакция/, но общее число реагирующих молекул, т.е. скорость реакции, зависит от числа столкновений, а, следовательно, зависит от разведения. Рассмотрим бимолекулярную реакцию типа: А + В = С + Д Обозначим С1 и С2 – концентрации веществ А и В, соответственно. Пусть v реакции, согласно постулату кинетики, для данной реакции при условии ее практической односторонности, выразится так: 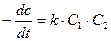 (7) Пусть a и b, исходные количества молей веществ А и В, V-объем системы. Если к моменту времени t прореагировало x молей ве (7) Пусть a и b, исходные количества молей веществ А и В, V-объем системы. Если к моменту времени t прореагировало x молей ве | |
| | | | | | | | |
| | ществ А и В, то концентрация веществ А и В, соответственно определяется 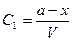 и и 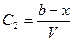 , а скорость реакции: , а скорость реакции: 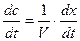 После подстановки этих выражений в уравнение (7) получим: После подстановки этих выражений в уравнение (7) получим: 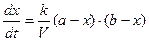 (8). Из этого уравнения видим, что скорость бимолекулярной реакции зависит от разведения. Интегрируя уравнение (8) и находя значение постоянной интегрирования при условиях t=0, x=0 получаем окончательное выражение для константы скорости бимолекулярной реакции: (8). Из этого уравнения видим, что скорость бимолекулярной реакции зависит от разведения. Интегрируя уравнение (8) и находя значение постоянной интегрирования при условиях t=0, x=0 получаем окончательное выражение для константы скорости бимолекулярной реакции: 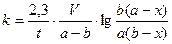 (9). Константа скорости реакции второго порядка, в отличие от константы скорости первого порядка, имеет размерность /время-1/концентрация-1/, и величина константы, следовательно, зависит от выбранных для концентрации единиц. Хорошо изученной бимолекулярной реакцией является реакция омыления сложного эфира щёлочью, которая описывается следующим уравнением: RA + MOH = ROH + MA, где RA – сложный эфир MOH – раствор щёлочи RON – алкоголь MA – соль Реакция омыления сложных эфиров щёлочью практически необратима и протекает с заметной скоростью. Выполнение работы Внимание! Работу в кислой и щелочной средах проводить параллельно! (9). Константа скорости реакции второго порядка, в отличие от константы скорости первого порядка, имеет размерность /время-1/концентрация-1/, и величина константы, следовательно, зависит от выбранных для концентрации единиц. Хорошо изученной бимолекулярной реакцией является реакция омыления сложного эфира щёлочью, которая описывается следующим уравнением: RA + MOH = ROH + MA, где RA – сложный эфир MOH – раствор щёлочи RON – алкоголь MA – соль Реакция омыления сложных эфиров щёлочью практически необратима и протекает с заметной скоростью. Выполнение работы Внимание! Работу в кислой и щелочной средах проводить параллельно! | | | | Часть I. Изучение скорости омыления сложных эфиров в присутствии кислоты В тщательно вымытую и пропаренную колбу емкостью 100 мл (желательно с притертой пробкой) наливают 50 мл 0,1н НСl. Колбочку закрывают пробкой и помещают в термостат на 10-15 минут пока раствор соляной кислоты в колбочке не примет температуру термостата. Затем, не вынимая из термостата колбочки, к раствору кислоты прибавить 2 мл сложного эфира (этилацетата). Тотчас же отбирают две пробы по 3 мл в ранее приготовленные колбочки с 10 мл воды, помещенные в лед. Титруют пробы щелочью (0,05н КОН), определяя содержание кислоты в начальный момент времени (t = 0). Пока титруется первая проба, колбочка со второй пробой остается во льду. Охлаждение взятых проб необходимо, так как при комнатной температуре гидролиз сложного эфира будет происходить и после отбора пробы и до момента титрования, и нельзя будет точно определить концентрацию кислоты в начальный период. После первого титрования через определенные промежутки времени (10, 30, 60, 120 мин) отбирается для каждого последующего титрования по одной пробе (3 мл) в колбочку с 10 мл дистиллированной воды, погруженную в охладительную смесь (лед). Избыток щелочи по сравнению с первоначальным титрованием, который идет на каждое последующее титрование, соответствует количеству сложного эфира, разложившегося к определенному моменту времениt. Общее количество сложного эфира, подвергшегося гидролизу, определяется из заключительного титрования, когда предполагается, что реакция гидролиза практически закончилась (через неделю). Колбочка с реакционной смесью оставляется до следующего занятия на рабочем месте. Заключительное титрование, соответствующее времени реакции t = ¥, проводится на очередном занятии. Для отбора пробы необходимо создать прежние условия протекания реакции. Для этого колбочку с реакционной смесью снова погружают в термостат на 15-20 минут, чтобы реакционная смесь приняла температуру термостата (температура термостата должна | |
| |
| | | | | |

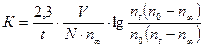 (12)
(12)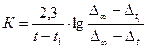
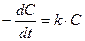 (1), интегрируя которое получим:
(1), интегрируя которое получим: 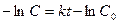 (2) или
(2) или 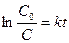 (3), откуда:
(3), откуда: 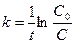 (4) – уравнение для константы скорости I-го порядка, {t-1}. где С0 - начальная концентрация эфира; С - концентрация эфира в данный момент времени t. В общем виде реакцию гидролиза эфира можно представить уравнением: RA + H2O = ROH + HA, гдеRA – сложный эфир; ROH – образующийся спирт; HA – образующаяся кислота. Скорость гидролиза, протекающего как реакция первого порядка, выразится уравнением:
(4) – уравнение для константы скорости I-го порядка, {t-1}. где С0 - начальная концентрация эфира; С - концентрация эфира в данный момент времени t. В общем виде реакцию гидролиза эфира можно представить уравнением: RA + H2O = ROH + HA, гдеRA – сложный эфир; ROH – образующийся спирт; HA – образующаяся кислота. Скорость гидролиза, протекающего как реакция первого порядка, выразится уравнением: 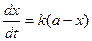 , (5) где х – количество разложившегося сложного эфира; а – первоначальное количество сложного эфира. Интегрируя последнее уравнение, получим выражение для константы скорости гидролиза сложного эфира:
, (5) где х – количество разложившегося сложного эфира; а – первоначальное количество сложного эфира. Интегрируя последнее уравнение, получим выражение для константы скорости гидролиза сложного эфира: 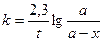 (6)
(6) 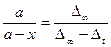 /10/. В этом случае константа скорости гидролиза сложного эфира выразится следующим образом:
/10/. В этом случае константа скорости гидролиза сложного эфира выразится следующим образом: 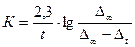 /11/. Как видно из уравнений (10) и (11) титр применяемой щелочи не нужен для расчета и может даже быть не известен, если для всех определений применять раствор щелочи постоянной концентрации. Следует отметить, что при вычислении констант скоростей ре
/11/. Как видно из уравнений (10) и (11) титр применяемой щелочи не нужен для расчета и может даже быть не известен, если для всех определений применять раствор щелочи постоянной концентрации. Следует отметить, что при вычислении констант скоростей ре 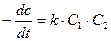 (7) Пусть a и b, исходные количества молей веществ А и В, V-объем системы. Если к моменту времени t прореагировало x молей ве
(7) Пусть a и b, исходные количества молей веществ А и В, V-объем системы. Если к моменту времени t прореагировало x молей ве 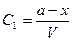 и
и 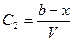 , а скорость реакции:
, а скорость реакции: 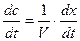 После подстановки этих выражений в уравнение (7) получим:
После подстановки этих выражений в уравнение (7) получим: 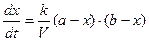 (8). Из этого уравнения видим, что скорость бимолекулярной реакции зависит от разведения. Интегрируя уравнение (8) и находя значение постоянной интегрирования при условиях t=0, x=0 получаем окончательное выражение для константы скорости бимолекулярной реакции:
(8). Из этого уравнения видим, что скорость бимолекулярной реакции зависит от разведения. Интегрируя уравнение (8) и находя значение постоянной интегрирования при условиях t=0, x=0 получаем окончательное выражение для константы скорости бимолекулярной реакции: 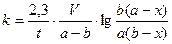 (9). Константа скорости реакции второго порядка, в отличие от константы скорости первого порядка, имеет размерность /время-1/концентрация-1/, и величина константы, следовательно, зависит от выбранных для концентрации единиц. Хорошо изученной бимолекулярной реакцией является реакция омыления сложного эфира щёлочью, которая описывается следующим уравнением: RA + MOH = ROH + MA, где RA – сложный эфир MOH – раствор щёлочи RON – алкоголь MA – соль Реакция омыления сложных эфиров щёлочью практически необратима и протекает с заметной скоростью. Выполнение работы Внимание! Работу в кислой и щелочной средах проводить параллельно!
(9). Константа скорости реакции второго порядка, в отличие от константы скорости первого порядка, имеет размерность /время-1/концентрация-1/, и величина константы, следовательно, зависит от выбранных для концентрации единиц. Хорошо изученной бимолекулярной реакцией является реакция омыления сложного эфира щёлочью, которая описывается следующим уравнением: RA + MOH = ROH + MA, где RA – сложный эфир MOH – раствор щёлочи RON – алкоголь MA – соль Реакция омыления сложных эфиров щёлочью практически необратима и протекает с заметной скоростью. Выполнение работы Внимание! Работу в кислой и щелочной средах проводить параллельно!