Ионные реакции обмена. Гидролиз солей.
Составьте молекулярные, ионные и сокращенно-ионные уравнения реакций, протекающих между следующими соединениями:
21. а) хлоридом железа (III) и фосфатом натрия;
б) гидроксидом цинка и гидроксидом калия;
22. а) сульфидом железа (II) и соляной кислотой;
б) оксидом цинка и гидроксидом натрия;
23. а) сульфатом никеля (II) и фторидом калия;
б) гидроксидом цинка и гидроксидом калия;
24. а) нитратом свинца (II) и хроматом калия;
б) гидроксидом алюминия и гидроксидом натрия;
25. а) нитратом серебра и хлоридом натрия;
б) гидроксидом свинца (II) и гидроксидом калия;
26. Какие из перечисленных ниже солей подвергаются гидролизу: хлорид калия, фосфат натрия? Составьте молекулярные и ионно-молекулярные уравнения происходящих реакций. Укажите рН водных растворов солей.
27. В какой цвет будет окрашена лакмусовая бумажка в водных растворах хлорида аммония, нитрата натрия? Составьте молекулярные и ионно-молекулярные уравнения происходящих реакций.
28. Какие из перечисленных ниже солей подвергаются гидролизу: сульфат цинка, нитрат калия, хлорид алюминия? Составьте молекулярные и ионно-молекулярные уравнения происходящих реакций. Укажите рН водных растворов солей.
29. При сливании водных растворов нитрата хрома (III) и сульфида натрия образуется осадок и выделяется газ. Составьте молекулярное и ионно-молекулярное уравнение происходящей реакции.
30. В какой цвет будет окрашена лакмусовая бумажка в водных растворах хлорида аммония, карбоната калия, нитрата натрия? Составьте молекулярные и ионно-молекулярные уравнения происходящих реакций.
Окислительно-восстановительные (о/в) реакции
31. Расставить коэффициенты в уравнении: методом ионно- электронного баланса
KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O
32 . Укажите вещества, которые могут являться и окислителем и восстановителем; HNO2; HNO3; H2SO3
33. Напишите продукты реакции взаимодействия конц. серной кислоты с медью. Расставьте коэффициенты.
34. Расставить коэффициенты в уравнении: методом электронного баланса
K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + K2SO4 + H2O
Расставить коэффициенты в уравнении: методом электронного баланса в следующих заданиях.
35. В реакции между растворами сульфата железа (II) и перманганата калия в сернокислой среде, используемой при определении сахара в пищевом сырье и продуктах по методу Бертрана.
36. В реакции между растворами йодида и йодата калия в сернокислой среде (с образованием йода), используемой для определения аскорбиновой кислоты и некоторых других органических восстановителей в пищевом сырье и продуктах.
37. В реакции между растворами перманганата калия и пероксида водорода в уксуснокислой среде, используемой при определении витамина В2 стандартными методами.
38. В реакции между растворами йодида калия и пероксида водорода в сернокислой среде, используемой при определении активных окислительных ферментов.
39. В реакции между растворами бромата и бромида калия в сернокислой среде (с образованием брома), используемой при определении сорбиновой кислоты и ее солей в пищевых продуктах.
40. В реакции между растворами дихромата и йодида калия в сернокислой среде, используемой при определении общего количества ароматических веществ в пищевых продуктах.
Теоретические основы разбора заданий
СТРОЕНИЕ АТОМА
Правило записи электронных формул
1. Порядковый номер элемента равен заряду ядра и числу электронов в электронной оболочке атома элемента.
2. Номер периода, в котором находится элемент, определяет число энергетических уровней в электронной оболочке атома.
3. Номер группы и принадлежность к подгруппе (главная, побочная) определяет число и распределение валентных электронов.
В зависимости от того, на какой энергетический подуровень попадает последний электрон при последовательном возрастании порядкового номера, элементы ПСЭ делятся на 4 электронных семейства: s-, р-, d- и f-элементы (исключением являются d-элементы Zn, Cd, Hg, у которых идет восстановление s-подуровня).
Основная цель электронных формул – возможность предсказания и объяснения на их основе свойств элементов и свойств соединений, которые они образуют.
Пример .Составьте электронные формулы для атома с порядковыми номерами 16
Ответ• Элемент с порядковым номером 16 – это сера, находится в третьем периоде, шестой группе. Следовательно, 16 электронов расположены на трех его энергетических уровнях. Электронная формула для атомов серы:
16S 1s2 2s2 2p6 3s2 3p4.
Так как последний электрон поступает на р-подуровень, сера – р-элемент.
16S 1s22s22p63s23p4 16S* –3s23p33d1
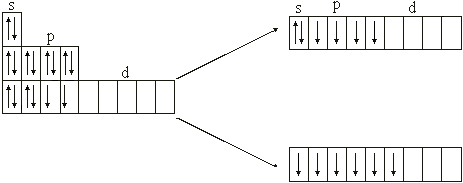
16S* –3s13p33d2
Химическая связь. ПСЭ и изменение некоторых свойств элементов и их химических соединений
Пример 1.Как и почему изменяются кислотно-основные и окислительно-восстановительные свойства кислот в ряду: НСlO — НСlО2 — НСlO3 — НСlO4?
Ответ:Изменение свойств в ряду кислородных кислот хлора можно выразить схемой:
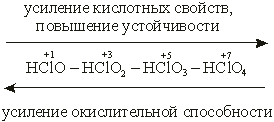
С увеличением степени окисления хлора устойчивость его кислородных кислот растет, а их окислительная способность уменьшается. Наиболее сильный окислитель – хлорноватистая кислота, наименее сильный – хлорная кислота.
Напротив, сила кислородных кислот хлора возрастает с увеличением его степени окисления. (С позиций теории электролитической диссоциации – легкость отщепления иона водорода.) Из всех гидроксидов хлора самая слабая кислота – хлорноватистая, самая сильная – хлорная. Это объясняется тем, что при возрастании степени окисления элемента (хлора) увеличивается заряд иона, что усиливает его притяжение к иону О2– и тем самым затрудняет диссоциацию гидроксида по типу основания. Вместе с тем усилится взаимное отталкивание одноименно заряженных ионов– хлора и водорода, что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисления элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого этим элементом гидроксида.
Ионные реакции обмена
Реакции, протекающие между растворенными в воде веществами за счет обмена составляющих их ионов, называются ионными реакциями обмена.
Такие реакции протекают необратимо, если образуются:
1) осадок или газообразное вещество;
2) малодиссоциированные соединения.
При написании реакций ионного обмена следует составить:
а) молекулярное уравнение, в котором все исходные вещества и продукты реакции записываются в виде молекул.
б) полное ионное уравнение, в котором все молекулы сильных электролитов записываются в виде ионов, а молекулы слабых электролитов (в том числе и Н2О) и неэлектролитов – в виде молекул.
в) сокращенное ионное уравнение, которое получают из полного ионного уравнения, сокращая, слева и справа, одинаковые частицы.
Продукты реакции ионного обмена образуются за счет электростатического притяжения положительно заряженных частиц одной молекулы и отрицательно заряженных частиц другой.
Рассмотрим примеры написания некоторых реакций ионного обмена.
1. Реакции, протекающие за счет образования малорастворимых веществ:
хлорид меди + фосфат калия
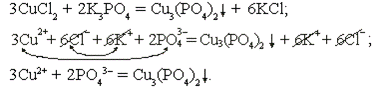 ;
;
Реакция необратима за счет образования не растворимого в воде фосфата меди.
2. Реакции, протекающие за счет образования газообразных веществ:
соляная кислота + гидросульфид бария
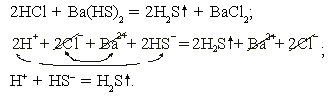
Реакция необратима за счет образования газообразного вещества сероводорода.
3. Реакции, протекающие за счет образования слабодиссоциирующих веществ:
а) ацетат натрия + соляная кислота
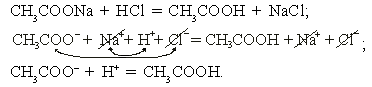
Реакция необратима за счет образования слабодиссоциирующего вещества – уксусной кислоты.
б) гидроксид алюминия + гидроксид натрия
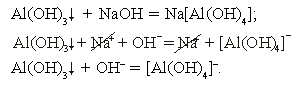
Растворение осадка гидроксида алюминия происходит в избытке щелочи (за счет амфотерных свойств). Реакция необратима за счет образования слабого электролита – комплексного иона [Al(OH)4]–.
По аналогии реакция протекает с гидроксидами сурьмы (III), хрома (III).
Гидролиз солей.
Для правильного ответа на вопросы этой темы необходимо помнить, что:
– Гидролизу подвергаются соли, образованные:
а) слабым основанием, сильной кислотой (рН < 7);
б) слабой кислотой, сильным основанием (рН > 7);
в) слабым основанием, слабой кислотой (рН = 7).
– К сильным основаниям относятся основания, образованные щелочными, щелочноземельными (Ca, Sr, Ba) металлами. К сильным кислотам относятся кислоты с Кд > 10–1 – 10–2 (например: H2SO4, HNO3, HCl, HI, HIO3 и др. ).
– Гидролизу подвергаются только растворимые в воде соли.
– Гидролиз следует рассматривать как реакцию ионного обмена между ионами соли и полярным растворителем – водой (представляющей собой диполь Н+– ОН–).
– В результате гидролиза образуются малодиссоциирующие продукты.
– Гидролиз большинства солей – процесс обратимый. Необратимому гидролизу с образованием осадков и выделением газа подвергаются карбонаты и сульфиды некоторых металлов (Аl3+, Сг3+ и др.).
– Процесс обратимого гидролиза многозарядных ионов протекает в большинстве случаев только по первой ступени из-за накопления в растворе Н+ или ОН–, приводящих к сдвигу равновесия влево.
– В реакциях обратимого гидролиза с одним гидролизующимся ионом – слабым составляющим соли – взаимодействует только одна молекула воды.
