Скорость химических реакций
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ В
Реакция между веществами А и В описывается уравнением
А(г) + 2В(г) = 2С(г).
Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ со(А) = 0,4 моль/л, со(В) = 0,8 моль/л. Вычислить начальную скорость реакции и определить во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
Дано: Уравнение реакции, К = 0,1 с 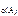 = 0,4 моль/л с = 0,4 моль/л с 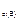 = 0,8 моль/л с = 0,8 моль/л с 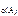 уменьшается на 0,1 моль/л уменьшается на 0,1 моль/л | Решение В простейших одностадийных реакциях скорость пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции. 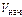 = K·с = K·с 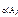 · · 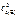 = = 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с). = = 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с). |
Vнач – ? 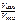 = ? = ? |
Исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции.
1моль А – 2 моль В
0,1 моль А – х моль В
х = 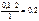 моль.
моль.
Следовательно, уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, тогда:
Vкон = К·сА· 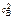 .
.
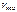 = 0,1(0,4 – 0,1)(0,8 – 0,2)2 = 0,0108 моль/(л·с).
= 0,1(0,4 – 0,1)(0,8 – 0,2)2 = 0,0108 моль/(л·с).
В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается:
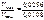 = 2,37,
= 2,37,
Т.е. скорость реакции уменьшилась в 2,37 раза.
Ответ: 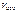 = 0,0256 моль/(л∙с).
= 0,0256 моль/(л∙с).
При уменьшении концентрации вещества А на 0,1 моль/л, скорость реакции уменьшилась в 2,37 раза.
2.Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость реакции: а) при повышении температуры от 320 до 360 К? б) если она протекает при 298 К в присутствии катализатора (Еак (кат)= 48 кДж/моль)?
Б) Зависимость скорости реакции от наличия катализатора выражается уравнением
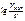 =
= 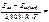
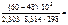 2,103,
2,103,
откуда 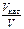 = 101,03= 127.
= 101,03= 127.
Ответ:
А) при повышении температуры от 320 до 360 К скорость реакции возрастает в 12,3 раза;
Б) в присутствии катализатора скорость реакции возрастает в 127 раз.
3.Используя справочные данные по ΔfHº(298 K) и Sº(298 K) веществ, определить температуру, при которой константа равновесия реакции CO2(г) + C(к) <=> 2CO(г) равна единице. Записать выражение для константы равновесия данной реакции.
Твердые вещества в выражение Кр не включаются.
Значения ΔfHº(298 K) и Sº (298 K) веществ берем из таблицы. По условию Кр = 1, следовательно, lgKp = 0, тогда
ΔrH°(298 K) – TΔrS°(298 K) = 0,
T = 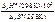 ,
,
где 103 – коэффициент пересчета килоджоулей в джоули.
ΔrHº(298 K) = 2ΔfHº(298 K, CO(г)) – [ΔfHº(298 K, CO2(г)) +
+ ΔfHº(298 K, Cк)]
ΔrHº(298 K) = 2(–110,5) – [(–393,5) + 0] = 172,5 кДж.
ΔrSº(298 K) = 2 Sº(298 K, CO(г)) – [Sº(298 K, CO2(г)) + Sº(298 K, C(k))] =
= 2·197,5 – (213,7 + 5,74) = 175,56 Дж/К.
Т = 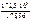 = 982,6 K.
= 982,6 K.
ΔrHº(298 K) – TΔrSº (298 K) = –2,303RTlgKp
Ответ: Кр = 1 при 982,6 К.
6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
УРОВЕНЬ В
1. Вычислить температуры кипения и замерзания водного раствора, содержащего 0,1 моль сахарозы ( 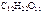 ) в 500 г раствора.
) в 500 г раствора.
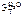 = 0,52 кг·К/моль,
= 0,52 кг·К/моль, 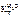 = 1,86 кг·К/моль.
= 1,86 кг·К/моль.
Дано: 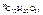 = 0,1 моль mр-ра = 500 г = 0,1 моль mр-ра = 500 г 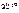 = 0,52 кг·к/моль = 0,52 кг·к/моль 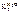 = 1,86 = 1,86 | Решение tкип р-ра = 100 ºС + ∆tкип, tзам р-ра = 0 ºС – ∆tзам , ∆tкип = 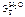 ·cm ( ·cm ( 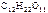 ), ∆tзам = ), ∆tзам = 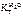 ·cm ( ·cm ( 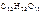 ), cm( ), cm( 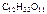 ) – моляльность сахарозы в растворе, моль/кг. ) – моляльность сахарозы в растворе, моль/кг. |
| tкип р-ра – ? tзам р-ра – ? |
cm( 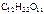 ) =
) = 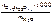 ,
,
где 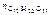 – количество растворенной сахарозы,
– количество растворенной сахарозы,
Моль.
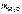 =
= 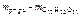 , г;
, г;
cm( 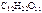 )
) 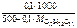
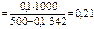 моль/кг,
моль/кг,
где М 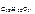 = 342 г/моль
= 342 г/моль
∆tкип = 0,52 ∙ 0,21 = 0,109 ºС;
tкип р-ра = 100 ºС + 0,109 ºС = 100,109 ºС;
∆tзам = 1,86∙0,21 = 0,391 ºС;
tзам р-ра = 0 ºС – 0,391 ºС = –0,391 ºС.
Ответ: tкип р-ра = 100,109 ºС;
tзам р-ра = – 0,391 ºС.
2. В 100 г воды содержится 2,3 г неэлектролита. Раствор обладает при 25 ºС осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита. Плотность раствора принять равной 1 г/см3.
Дано: mв = 2,3 г t = 250C 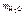 = 100 г π = 618,5 кПа ρр-ра = 1 г/см3 = 100 г π = 618,5 кПа ρр-ра = 1 г/см3 | Решение π = св ∙ R ∙ T, кПа. R = 8,314 л∙кПа/(моль∙К). св – молярная концентрация вещества, моль/л. Vр-ра = mр-ра/ρр-ра = (mB + m 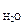 )/ρр-ра , см3. Vр-ра = )/ρр-ра , см3. Vр-ра = 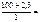 102,3 см3 = 0,102 л. 102,3 см3 = 0,102 л. |
| МВ – ? |
св = 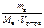 , моль/л,
, моль/л,
где mв – масса растворенного неэлектролита, г;
Мв – молярная масса растворенного неэлектролита, г/моль.
π = 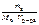 ∙ R ∙ T, кПа;
∙ R ∙ T, кПа;
Мв = 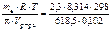 = 90,33 г/моль.
= 90,33 г/моль.
Ответ: молярная масса растворенного вещества равна 90,06 г/моль.
3. Определить давление насыщенного пара воды над 1,0 %-м раствором карбамида (CO(NH2)2) при 298 К, если давление насыщенного пара над водой при той же температуре равно 2,34 кПа.
Дано: 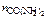 = 1,0 % Т = 298 К po = 2,34 кПа = 1,0 % Т = 298 К po = 2,34 кПа | Решение р = рo∙ 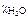 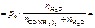 = = 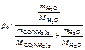 , , |
| Р – ? |
где р – давление насыщенного пара воды над раствором, кПа,
рo – давление насыщенного пара воды, кПа;
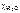 – молярная доля воды;
– молярная доля воды;
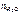 – количество воды, моль;
– количество воды, моль;
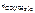 – количество CO(NH2)2, моль;
– количество CO(NH2)2, моль;
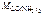 = 60 г/моль,
= 60 г/моль, 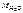 = 18 г/моль.
= 18 г/моль.
В 100 г 1 %-го раствора карбамида содержится 1 г карбамида и 99 г воды.
р = 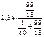 = 2,33 кПа.
= 2,33 кПа.
Ответ: давление насыщенного пара воды над 1 %-м раствором CO(NH2)2 составляет 2,33 кПа.

