Предельные и непредельные АЦИКЛИЧЕСКИЕ углеводороды
Лабораторная работа № 1
1.1. Цель работы: Изучение способов получения и физико-химических свойств алканов, алкенов и алкинов.
1.2. Теория: Теория строения органических соединений А.М. Бутлерова. Классификация органических соединений: ациклические (неразветвленные, разветвленные) и циклические соединения (алициклические, ароматические, гетероциклические). Номенклатура органических соединений. Основные функциональные группы. Изомерия органических соединений. Индуктивный и мезомерный эффекты заместителей. Классификация органических реакций (реакции замещения, присоединения, элиминирования; радикальные и ионные реакции; нуклеофильные и электрофильные реакции). Алканы, алкены, алкины, арены: номенклатура, изомерия, получение, физические и химические свойства, применение.
1.3 Оборудование и реактивы: Пробирки, пробка с газоотводной трубкой, спиртовка, спички, ступка с пестиком, кипятильники.
Натронная известь (гидроксид натрия NaOH (к) и оксид кальция CaO (к)), сода NaHCO3 (к), бензин (или керосин), любой жидкий алкен, ацетат натрия CH3COONa (к), карбид кальция CaC2 (к), спирт этиловый C2H5OH, дистиллированная вода; растворы: серная кислота H2SO4 (конц.), перманганат калия KMnO4 (2%), бромная вода (Br2/H2O), карбонат натрия Na2CO3 (10%), хлорид натрия NaCl (насыщ.).
1.4 Экспериментальная часть:
Техника безопасности. Все работы проводятся под тягой или в хорошо проветриваемом помещении. Бром оставляет ожоги на коже. Продукты реакций выливайте в банку для слива отходов. Этилен и другие алкены относятся к малотоксичным соединениям, однако опыты с ними необходимо проводить под тягой или в проветриваемом помещении, т.к. они имеют неприятный бензиновый запах. При получении этилена в качестве побочного продукта выделяется сернистый газ, обладающий раздражающим действием на органы дыхания. Октин имеет резкий запах.
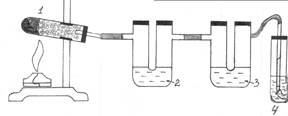 Опыт 1. Получение и горение метана. Отношение метана к водному раствору перманганата калия и бромной воде
Опыт 1. Получение и горение метана. Отношение метана к водному раствору перманганата калия и бромной воде
В сухую пробирку насыпьте (на 1/4 объема) смесь CH3COONa и натронной извести (смесь NaOH и CaO). Пробирку закройте пробкой с газоотводной трубкой, закрепите в штативе (с небольшим наклоном в сторону пробки во избежание растрескивания пробирки при нагревании из-за выделяющейся воды!) и нагрейте.
Подожгите выделяющийся метан у конца газоотводной трубки. Наблюдаем, что метан горит _______________. Не прекращая нагревания смеси, газоотводную трубку последовательно введите в пробирку с бромной водой (1–2 мл), пропуская несколько минут метан, а затем в пробирку с раствором KMnO4 (2 мл).
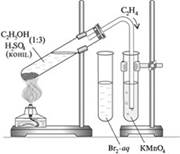 Опыт 2. Получение и химические свойства этилена
Опыт 2. Получение и химические свойства этилена
В сухую пробирку налейте 2 мл этанола и 4 мл конц. H2SO4. В реакционную смесь поместите несколько кипятильников (для равномерного кипения), закройте пробирку пробкой с газоотводной трубкой и закрепите пробирку в штативе; пробирку осторожно нагрейте.
Выделяющийся этилен последовательно пропустите через бромную воду и раствор KMnO4 (реакция Вагнера):
3CH2=CH2 + KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2↓ + 2KOH
этиленгликоль
После проведения вышеописанных реакций подожгите этилен у конца газоотводной трубки. Наблюдаем, что этилен горит _____________.
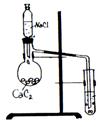 Опыт 3. Получение и химические свойства ацетилена(тяга!)
Опыт 3. Получение и химические свойства ацетилена(тяга!)
В сухую колбу поместите несколько кусочков карбида кальция CaC2 (размером 0,5 см3), закрепите ее в штативе и из капельной воронки прилейте немного насыщенного раствора NaCl.
Выделяющийся ацетилен пропустите через бромную воду и раствор KMnO4 (с добавлением раствора соды).
Выделяющийся ацетилен пропустите через раствор KMnO4 (с добавлением раствора соды) – образуется щавелевая кислота НООС–СООН.
После проведения вышеописанных реакций подожгите ацетилен у конца газоотводной трубки. Наблюдаем, что ацетилен горит ____________.
