Непредельные этиленовые углеводороды. Алкены. Олефины
Алкены- алифатические углеводороды, молекулы которых содержат одну двойную углерод-углеродную связь С=С.
| Строение | Химические свойства | Получение | |||||||||||||||
Общая формула- СnH2n (- ен, -илен)  С2Н4 – этен, этилен CH2=CH2гомологи С3Н6 - пропен С4Н8 - бутен С2Н4 – этен, этилен CH2=CH2гомологи С3Н6 - пропен С4Н8 - бутен
CH2=CH- винил CH3-CH=CH-радикалы пропенил, аллил Изомерия С4Н8 · Структурная - углеродного скелета C=C-C-C; C= C-C бутен-1 | 2-метилпропен C - Положения кратной связи C=C-C-C; C-C =C-C; бутен-1 бутен-2 · Пространственная
цис-бутен-2; транс-бутен-2 · Межклассовая(метамерия)
бутен-2 циклобутан С С Физические свойства С2 – С4 - газы С5– С15 – жидкости С16 и > твердые С увеличением n t0кип и t0пл↑ t0кип (н) > t0кип (разв.), · t0кип цис > t0кип транс | · алкены построены из углеродных цепей; · атомы углерода не насыщены атомами водорода. · атомы углерода находятся в состоянии sp2- гибридизации: 1S + 2Р → 3SР2
три σ-связи С – С - SР2- SР2; С – Н - SР2 – S · валентный угол 1200 есть π-связи Pz- Pz · форма молекулы плоская · длина двойной связи 0,134 нм (нанометров) (1 нм = 10-7см.) · энергия двойной связи С=С 598 кДж/моль · Радикал, связанный с атомом углерода при двойной связи, отталкивает от себя электронную плотность в сторону двойной связи, вызывая смещение подвижного электронного облака π-связи в сторону крайнего атома углерода, возникает поляризация молекулы | · π-связь легче рвется, поэтому более реакционно- способна, чем σ-связь. Реакции идут в мягких условиях (н.у) по ионному механизму: Х|:У→Х+ + У- · основные реакции присоединения(Н2; Г2; НГ; Н2О) - электрофильное присоединение 1. Гидрирование:CH2=CH2+Н2→CH3-CH3 (t0,Ni,Рt,Pd) 2. ГалогенированиеCH2=CH2 + Br2→CH2 Br -CH2 Br качественная реакция (обесцвечивание бромной воды) 3. Гидрогалогенирование (по правилу Марковникова - водород присоединяется к наиболее гидрированному атому углерода при двойной связи) CH3-CH=CH2 + НСl → CH3-CHСl –CH3 Но при появлении в молекуле более электроотрицательного атома (Cl) идет смещение электронной плотности на него и реакция идет против правила Марковникова. CH3-CСl=CH2δ+ + Н δ+ Сl δ- → CH3-CHСl –CH2Сl 4. Гидратации:CH2=CH2+Н2О → CH3-CH2ОН(H+) 5. Полимеризации(механизм радикальный цепной) n CH2=CH2→ (- CH2- CH2-) n (t0, P) 6. Горение:С2Н4 + 3О2→2СО2+2Н2О + Q (t0) 7. Окисление: · CH2=CH2 +[ О] + Н2О → CH2ОН- CH2ОН 3CH2=CH2+2KMnO4 + 4Н2О→3CH2ОН- CH2ОН + 2КОН + 2 MnO2; этиленгликоль - качественная реакция Вагнера Е.Е. Более жесткие условия (t0, Н+) приводят к образованию кислот, кетонов по месту разрыва = связи. · 5CH3-CH2=CH2-CH3+8KMnO4 + 12Н2SО4 → 10CH3COОН + 4К2SО4 + 8MnSO4 + 12Н2О; 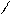 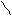 O · 2CH2=CH2 + О2 → 2 CH2- CH2 (3000,Ag - кат) этиленоксид PdCl2/CuCl2 · 2CH2=CH2 + О2 → 2CH3-CHО 8. Радикальное замещение (5000 или hν) CH3-CH=CH2+ Cl2 → CH2Сl -CH=CH2+ НCl Замещению подвергается атом Н при α-углеродном атоме (расположенном по соседству с = связью) O · 2CH2=CH2 + О2 → 2 CH2- CH2 (3000,Ag - кат) этиленоксид PdCl2/CuCl2 · 2CH2=CH2 + О2 → 2CH3-CHО 8. Радикальное замещение (5000 или hν) CH3-CH=CH2+ Cl2 → CH2Сl -CH=CH2+ НCl Замещению подвергается атом Н при α-углеродном атоме (расположенном по соседству с = связью) | 1.Крекинг нефтепродуктов:(t0,Ni) С16Н34 → С8Н18 + С8Н16 С8Н18 → С4Н8+ С4Н10 С4Н10 → С2Н6 + С2Н4 2.Дегидрирование алканов(по радикальному механизму) t0, Al2O3 CH3-CH2-CH3 → CH3-CH=CH2+ Н2 Образуется алкен, содержащий максимально возможное число алкильных заместителей при двойной связи. 3.Из дигалогенопроизводных: - дегалогенирование (t0) CH2Br-CH2Br + Zn (пыль) → ZnBr2+ СH2=CH2 4.Из алкилгалогенидов в спиртовом растворе щелочи: - дегидрогалогенирование t0 CH3-CH2Сl +КОНсп. → CH2=CH2 + КСl +Н2О 5.Дегидратацией спиртов t0 >1800, Н2SO4(конц) CH3-CH2ОН→ CH2=CH2+Н2О Отщепление (элиминирование) определяется правилом Зайцева: водород отщепляется от наименее гидрированного (меньше атомов водорода) атома углерода. 6.Из алкинов - гидрирование CH ≡CH + Н2 → CH2=CH2(Pd) 7.Деполимеризацией (t0) Применение · Моторное топливо, производство пластмасс. · Дихлорэтан- растворитель; хлорэтан- местная анестезия, обеззараживание зернохранилищ; этилен- регулятор роста растений. · Для получения спиртов, антифризов, тормозных жидкостей. |
Задания по теме «Алкены»
| А.1 И бутан и бутилен реагирует с: 1) бромной водой 2) раствором KMnO4 3) водородом 4) хлором А.2 Продуктом реакции пропена с хлором является: 1) 1,2-дихлорпропен 2) 2-хлорпропен 3) 2-хлорпропан 4) 1,2 дихлорпропан А. 3 Продуктом реакции бутена-1 с хлором является: 1) 2-хлорбутен-1 2) 1,2 – дихлорбутан3) 1,2- дихлорбутен-1 4) 1,1-дихлорбутан А. 4. Превращение бутана в бутен относится к реакциям: 1) полимеризации 2) дегидрирования3) дегидратации 4) изомеризации А.5.При гидрировании алкенов образуются: 1) алканы 2) алкины 3) алкадиены 4) спирты А.6. При действии спиртового раствора щелочи на 2-хлорбутан преимущественно образуется: 1) бутен-1 2) бутен-23) циклобутан 4) метилциклопропан А.7 В молекуле этилена между атомами углерода образуется 1) две π-связи 2) две σ-связи 3) одна σ- и одна π-связь 4) две π- и одна σ- связь А.8 В молекуле этилена все атомы углерода находятся в состоянии 1) sp-гибридизации 2) sp2-гибридизации 3) sp3-гибридизации 4) первом валентном состоянии А.9 С изобутеном не взаимодействует:1) бром 2) водород 3) хлороводород 4) азот А.10 С водой в присутствии катализатора реагирует 1) толуол 2) пропен 3) пропан 4) бензол А.11. Бутен-1 не взаимодействует с 1) хлором 2) бромоводородом 3) водой 4) аммиачным раствором оксида серебра А.12. 2-бромбутан превращается в бутен-2 при действии 1) водного раствора гидроксида калия 2) спиртового раствора гидроксида калия 3) серной кислоты при нагревании ( t › 1400 С) 4) водорода А.13. При взаимодействии бутена-1 с бромоводородом образуется преимущественно 1) 2-бромбутан 2) 2-бромбутен-1 3) 1-бромбутан 4) 1-бромбутен-1 А.14. Продуктом взаимодействия бутена-1 с бромоводородом является 1) 1-бромбутен-2 2) 1,2-дибромбутан 3) 2-бромбутан4) 1-бромбутан А.15. Как предельные, так и непредельные углеводороды реагируют с 1) водородом 2) бромной водой 3) кислородом 4) углекислым газом А. 16.Этилен из этанола можно получить в результате реакции 1)дегидратации 2) дегидрирования 3) дегидрогалогенирования 4) дегалогенирования А.17. Этилен гидратируют с целью получения 1) спирта2) простого эфира 3) альдегида 4) карбоновой кислоты А.18.Для пропена характерна изомерия 1) углеродного скелета 2) геометрическая 3) положения двойной связи 4) межклассовая А.19.Полипропилен получают из вещества, формула которого 1) CH2=CH2 2) CHºCH 3) CH3-CH2-CH3 4) CH2=CH-CH3 А.20. С бромоводородом вступает в реакцию 1) гексан 2) гексен 3) циклогексан 4) бензол А.21.В молекуле 2-метилбутена-2 гибридизация орбиталей углеродных атомов 1) только sp3 2) только sp2 3) sp3 и sp2 4) sp3 и sp | А. 22.В одну стадию бутан можно получить из 1) бутанола-1 2) бутановой кислоты 3) бутена – 1 4) бутанола-2 А.23. С каждым из веществ: водой, бромоводородом, водородом может реагировать: 1) пропан 2) бутен – 1 3) этан 4) хлорметан А. 24.Продукт гидратации бутена-1 1) бутанол-2 2) бутанол-13) бутанон4) бутан В. 1.Алкены взаимодействуют с 1) [Ag(NH3)2]ОН 2) Br2 р-р 3) Cu(OH)2 4) KMnO4 (H+) 5) Н2О 6) Ca(OH)2 В. 2.Для метана и для пропена характерны: 1) реакция бромирования2) sp – гибридизация атомов углерода в молекуле 3) наличие π-связи в молекулах 4) реакции гидрирования 5) горение на воздухе 6) малая растворимость в воде В.3. К способам получения алкенов относят: 1) дегидрирование алканов 2) гидрирование бензола 3) дегидратацию спиртов 4) отщепление галогеноводородов от галогеналканов 5) ароматизацию предельных углеродов 6) гидратацию альдегидов В.4. Углеводороды ряда этилена будут реагировать с каждым из веществ, указанных в ряду 1) Br2, HCl, C3H8 2) KMnO4,H2, Н2О 3) NaH, C6H6, Br2 4)HCHO, CH4, HBr 5) Н2, O2, HCl 6) Н2O, HCl, Br2 В.5 Для бутена-2 характерно 1) наличие атомов углерода в 4-х валентном состоянии 2) наличие пространственной изомерии 3) жидкое агрегатное состояние (н.у.) 4) взаимодействие с гидроксидом натрия (спир. р-р) 5) взаимодействие с водородом 6) обнаружение его бромной водой Решите задачи: 1.Массовая доля углерода в углеводороде равна 85,71%, 10л паров этого вещества (н.у.) имеют массу 18,75 г. Определите молекулярную формулу и плотность этого углеводорода по воздуху.(1,448) 2.Смесь этана и этилена объемом 3л пропустили через раствор брома, при этом образовался 1,2-дибромэтан массой 4,7 г. Определить массовые доли газов в смеси. ( 17,6 % и 82,4%) 3.Алкен массой 7 г присоединяет 2,24 л бромоводорода. Определите молекулярную массу и структурную формулу алкена, если известно, что он является цис-изомером.(С5Н10) 4.На 2,52 г гексена- 3 подействовали 0,7 г воды в присутствии концентрированной серной кислоты, найдите массу образовавшегося продукта. (3,06г) 5.Найдите объем водорода (н.у), необходимый для гидрирования 50л смеси пропана и пропена, если объемная доля пропана в нем 20%. (40л) 6.Сколько граммов брома может присоединить 4,3 г смеси этилена и бутена-2, содержащей 32,55% этилена ? (16 г) 7.Смесь пропана и пропилена массой 25г поглотила при обработке 16 г брома. Определите количество вещества пропана и пропилена в смеси. (0,1моль и 0,47 моль) |
Дополнительные задания по теме «Алкены»
| Выполните упражнения | Знаешь ли ты, что… |
| 1. Определить количествоσ- и π-связей в молекуле изобутилена. Каков тип гибридизации атомов углерода и каковы углы между связями?. 2.Из перечисленных соединений выберите для метилпентена а) изомеры б) гомологи: 1. Бутан 2. Метилнонен 3. Гептен 4. Триметилбутан 5. Этилен 6. Этилпентен 7.Ацетилен 8.Диметилбутен 9.Бутадиен. Все ли правильно названы? 3. Напишите не менее трех реакций получения бутена- 1. 4. Обсудитепродукты реакции хлора с нижеприведенными соединениями. Укажите условия реакций, возможные пути взаимодействия. а) этилен; б) пропилен; в) циклогексан; г) 2-метил-бутен-2; д) 2-метилбутен-1; е) 4-метилпентен-2. 5. Напишите уравнения химических реакций к следующим схемам. Назовите продукты реакции: NaОНсп..р-р + Н2О 1. 1-бром-2-метилбутан → ? → ? NaОНсп..р-р +Н2 (Ni) Сl2; hν + Na 2. 2-бром-2метилпропан → ? → ? → ? → ? | 3. При окислении алкенов важны условия проведения химических реакций: · Если окислитель KMnO4 водный или Н2О2 (кат-Cr2O3) получаются гликоли (спирты) · При действии сильных окислителей в более жестких условиях (температура, кислая среда) может происходить расщепление по месту = связи с образованием кислот и кетонов. К2Сr2О7 /Н+ ü CH3−CH2 −CH2 −CH = CH−CH3 → CH3CООH + C3 H7 CООH ü CH2=C(СH3)CH2 CH2-СН3 + KMnO4 +Н2SO4 →СО2 +СН3CО CH2CH2СООН + МnSO4 + К2SO4 KMnO4/ Н+ ü СH3−CH2− C = CH −СН3 → CH3−CО −СН3 + CH3-СООН Алкены реагируют с озоном 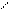 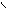 О О 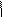  Н2С CH2 ü CH2=CH2 + О3 → Н2С CH2 ü CH2=CH2 + О3 →  О О Озонид этилена неустойчив, гидролизуется О О Озонид этилена неустойчив, гидролизуется 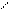 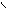 О О  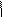 Н2С CH2 ü + Н2О → 2 СН2=О + Н2О2 (но в этом случае) Н2С CH2 ü + Н2О → 2 СН2=О + Н2О2 (но в этом случае)  О О ü 2 СН2=О + Н2О2 → НСООН + Н2О 4. В присутствии перекиси водорода идет вопреки правилу В.В. Марковникова и присоединение бромоводорода. Н2О2 ü CH3-CH=CH2- СН3 + НBr → CH2 Br-CH2-CH2–CH3 Задание:Какой алкен подвергли окислению горячим кислым раствором перманганата калия, если были идентифицированы следующие продукты: а) ацетон; б) уксусная кислота и метилэтилкетон; в) этанкарбоновая кислота г) 2-метил- пропионовая кислота и углекислый газ; д) бутанкарбоновая кислота и уксусная кислота? Напишите уравнения реакций, назовите олефины по правилам ИЮПАК. О О ü 2 СН2=О + Н2О2 → НСООН + Н2О 4. В присутствии перекиси водорода идет вопреки правилу В.В. Марковникова и присоединение бромоводорода. Н2О2 ü CH3-CH=CH2- СН3 + НBr → CH2 Br-CH2-CH2–CH3 Задание:Какой алкен подвергли окислению горячим кислым раствором перманганата калия, если были идентифицированы следующие продукты: а) ацетон; б) уксусная кислота и метилэтилкетон; в) этанкарбоновая кислота г) 2-метил- пропионовая кислота и углекислый газ; д) бутанкарбоновая кислота и уксусная кислота? Напишите уравнения реакций, назовите олефины по правилам ИЮПАК. |

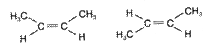
 C-C =C-C; С С
C-C =C-C; С С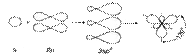

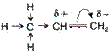 молекула поляризована
молекула поляризована