Примеры решения задач
КОНТРОЛЬНАЯ РАБОТА №2
по курсу «Аналитическая химия» (3 семестр)
Теоретические вопросы, включаемые в задания текущей контрольной работы
1. Кислотно-основное равновесие. Теория Бренстеда-Лоури.
2. Кислотно-основные свойства растворителей.
3. Кислотно-основное равновесие в воде. Расчет равновесия в системе одноосновная кислота – сопряженное основание.
4. Принцип расчета равновесия в системе многоосновная кислота – многокислотное основание.
5. Расчет концентрации компонентов при заданном рН.
6. Буферные растворы. Буферная ёмкость.
Примеры решения задач
В практических расчетах важно выбрать необходимую степень приближения, поскольку она определяет точность полученного результата. В обычной лабораторной практике погрешность изменения рН растворов составляет ±0,01 - 0,02 единицы рН, что соответствует относительной погрешности в [H+] » 5 %. Отсюда следует, что принимаемые в вычислениях допущения не должны приводить к большой погрешности. Ниже мы использовали два допущения.
Первое допущение заключается в исключении вклада диссоциации воды в концентрацию Н+ или ОН-. Учитывая выше сказанное, это допущение можно признать справедливым, если вклад автопротолиза воды в [H+] или [OH–] не превышает 5%. Критерием, указывающим на необходимость учета автопротолиза воды, может служить найденное значение рН. Если это значение находится в приделах 6,4 - 7,6, то поправка на диссоциацию воды необходима. Обычно концентрация электролитов в растворе составляет 0,01 - 0,1 М. Отсюда следует, что диссоциация воды следует учитывать только в растворах слабых электролитов, константа диссоциации которых £10-12.
Второе допущение относится к растворам слабых кислот и оснований. Предполагается, что степень протекания диссоциации кислот и оснований мала и, вместо равновесной концентрации в расчетах используется общая концентрация. Учитывая, что погрешность вычисления не должна превышать 5 %, можно получить приближенный критерий применимости этого допущения. Таким приближенным критерием является выполнение условий
[H+]=[B]£0,05cA (раствор кислоты)
[OH–]=[A]£0,05cB (раствор основания)
Подставив эти неравенства в формулы (3.28) и (3.31), получим
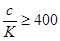
Следовательно, если общая концентрация кислоты или основания в 400 и более раз больше соответствующей константы равновесия, вычисления рН растворов можно проводить с помощью простых уравнений (3.28) и (3.31) .
Рассмотрим несколько примеров.
Пример 1. Рассчитать концентрацию ионов водорода в 0,08 М растворе СНСl2СООН. Константа диссоциации дихлоруксусной кислоты равна 5,0´10-2.
Решение. Определяем отношение
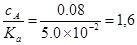
Так как это отношение меньше 400, то рассчитываем [H+], решая квадратное уравнение
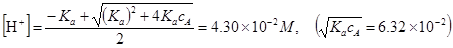 , рН=1.37.
, рН=1.37.
Пример 2. Рассчитать рН 0.01 М раствора этаноламина, H2NCH2CH2OH, Kb=1,8´10-5
Решение. Согласно уравнению реакции
H2NCH2CH2OH+H2OÛH3N+CH2CH2OH+OH-,
этаноламин проявляет свойства основания. Отношение
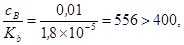
поэтому рассчитываем [OH–]по упрощенной формуле
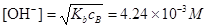 ,
,
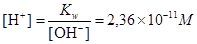 , pH=10,63.
, pH=10,63.
Пример 3. Рассчитать рН 0.02 М раствора NaOCl. Константа ионизации хлорноватистой кислоты, Ка=5.0´10-8 .
Решение. В растворе NaOCl устанавливается равновесие
OCl-+H2OÛHOCl+OH-.
Константа ионизации OCl-
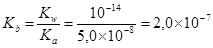 .
.
Отношение
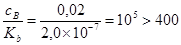 ,
,
поэтому рассчитываем [OH-] по формуле
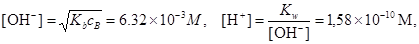 рН=9.80
рН=9.80
Пример 4. Рассчитать концентрацию ионов водорода в 0.001 М растворе солянокислого уротропина(CH2)N4H+. Константа диссоциации (CH2)N4, Kb=1,4´10-7.
Решение. В растворе солянокислого уротропина устанавливается равновесие
(CH2)N4H++H2OÛ(CH2)N4+H+.
Константа ионизации (CH2)N4H+
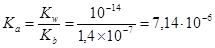 .
.
Отношение
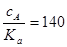 ,
,
поэтому рассчитываем [H+], решая квадратное уравнение
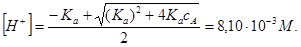
В рассматриваемых выше примерах мы не учитывали коэффициенты активности ионов. Тем самым мы считали, что ионная сила раствора мала или что в расчетах использовали концентрационные константы диссоциации, отвечающие условиям равновесия. Значение констант диссоциации, приводимые в справочниках, как правило, отвечают предельно разбавленным растворам, т.е. являются термодинамическими. Их применение в растворах со значительной ионной силой может привести к большим погрешностям, особенно если растворы содержат многозарядные ионы. Мы ограничимся рассмотрением растворов с умеренной ионной силой (I£0,1 M), для которых возможно достаточно точное количественное описание.
Наиболее просто внести поправку на ионную силу в растворах, в которых ионная сила полностью контролируется фоновым электролитом. В подобных системах по известной ионной силе рассчитывают коэффициенты активности ионов. Затем находят концентрационные константы равновесия, с помощью которых вычисляют значение [H+] подобно тому, как описано выше. Если окажется, что ионная сила в результате диссоциации слабого электролита все же изменяется, ее следует уточнить и повторить все вычисления заново.
Пример 5. Рассчитать концентрацию ионов водорода в 0,015 М растворе СН3СООН, содержащем 0,02 М СаСl2. Константа диссоциации СН3СООН, К°а=1,76´10-5.
Решение. Считая, что ионная сила раствора полностью определяется СаСl2, находим
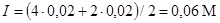
Рассчитываем по расширенному закону Дебая-Хюккеля значения коэффициентов активности ионов
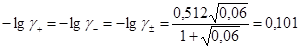
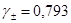
Концентрационная константа ионизации СН3СООН
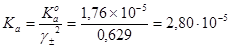
Так как отношение
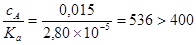 ,
,
для вычисления [H+] применяем формулу
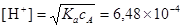 .
.
Концентрация Н+, а, следовательно, и СН3СOО- по сравнению с ионной силой, создаваемой СаСl2, мала и поэтому окончательно имеем
[H+]=6,48´10-4 M.
Пример 6. Рассчитать концентрацию ионов водорода в 0,05 М растворе СН2СlCOOH, содержащем 0,04 М NaCl. Константа диссоциации CH2ClCOOH, K°a=1,38´10-3.
Решение. Считая , что ионная сила раствора полностью определяется NaCl, находим
I=(0,04+0,04)/2=0,04 M
Рассчитываем по расширенному закону Дебая- Хюккеля значение коэффициентов активности ионов
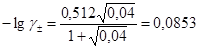 , .
, .
Концентрационная константа ионизации CH2ClCOOH
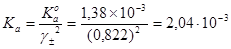 .
.
Отношение
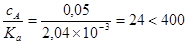 .
.
Значение [H+] вычисляем с помощью квадратного уравнения
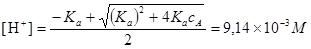 .
.
Значение концентрации ионов водорода и хлорацетата сопоставимы с ионной силой, создаваемой хлоридом натрия. Более точное значение ионной силы равно
I= 0,04+0,00914=0,049 M.
Повторяем все расчеты заново
,
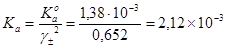
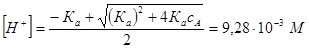
Учитывая, что ионная сила по второму приближению практически не отличается от предыдущего значения, окончательно имеем:
[H+]=9.28´10–3 М, pH=2.03.
Случай, когда ионная сила раствора определяется диссоциацией слабого электролита, отличается от предыдущего только тем, что ионная сила заранее неизвестна. Ее приближенную оценку проводят, исходя из конкретных условий задачи. Рассмотрим несколько таких примеров.
Пример 7. Рассчитать концентрацию ионов водорода в 0,01 М растворе HF. Константа диссоциации HF, K°a=6,75´10-4.
Решение. Так как концентрации ионов нам неизвестны, примем I=0 (т.е. Ka= K°a) и найдем отношение
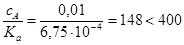 .
.
Отсюда в первом приближении
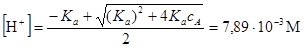 .
.
Ионная сила, создаваемая ионами водорода и фторида,
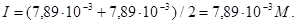
Значения коэффициентов активности ионов будут равны
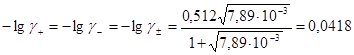 ,
, 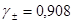
Концентрационная константа ионизации HF
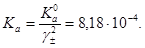
Повторяем все расчеты заново
[H+]=8.65×10-3 M, I=8.65×10-3, lgg+=, lgg-=, lgg±=0.0436, g±=0.905, Ka=8.25×10-4
Значение концентрации в третьем приближении,
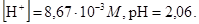
Так как значения [H+] во втором и третьем приближениях хорошо согласуются между собой (относительное отклонение меньше 5%), дальнейшие уточнения можно прекратить.
Пример 8. Рассчитать [H+] в 0.01 М растворе H2S, константы диссоциации которой равны: Ka1=8.9´10–8, Ka2=1.3´10–13.
Решение. Поскольку Ka1>>Ka2, считаем, что H2S диссоциирует только по первой ступени и рассчитываем концентрацию ионов водорода по формуле
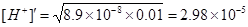 .
.
Из формулы (3.44) следует,
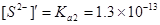 .
.
Сравнивая значения [H+]¢ и [S2–]¢, приходим к выводу, что принятое допущение оправдано и окончательно
[H+]=[H+]¢=2.98´10-5.
Пример 9. Рассчитать [H+] в 0.0001 М растворе янтарной кислоты H2C2H4O4, константы диссоциации которой равны: Ka1=6.21´10–5, Ka2=2.3´10-6.
Решение. Считаем, что H2C2H4O4 диссоциирует только по первой ступени. Так как 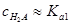 , решаем квадратное уравнение
, решаем квадратное уравнение
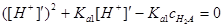 ,
,
[H+]¢=5.37´10–5.
Значение [C2H4O42–]¢=Ka2=2.3´10–6 сравнимо по величине с [H+]¢ и поправка на вторую ступень диссоциации янтарной кислоты, по-видимому, необходима. Значение [C2H4O42–]¢¢ находим решением уравнения
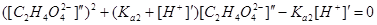 .
.
Она равна 2.12´10–6. Отсюда
[H+]=[H+]¢¢=5.37´10–5+2.12´10–6=5.58´10–5.
Пример 10. Рассчитайте рН раствора, образовавшегося при добавлении 29,00 мл 0,1000 M. раствора NaOH к 25,00 мл раствора, содержащего 0,1200 М НСl и 0,0800 М НА (Ка=1,00×10-4).
Решение. Рассчитаем концентрации НСl и НА после добавления раствора NaOH:
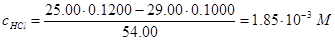
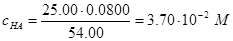
Таким образом,
[Н3O]=cHCl+[А-]=1,85×10-3+[А-]
Кроме того, мы можем записать, что
cHA =[НА]+[А-]=3,70×10-2.
Преобразуем выражение для константы кислотной диссоциации так, чтобы можно было найти [НА]:
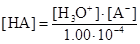
Совместное решение двух последних уравнений дает
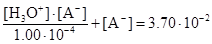 .
.
Отсюда найдем [А-]:
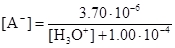 .
.
Отсюда
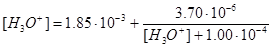
или
[Н3О+]=3,03×10-3 М, рН=2,52.
Видим, что в данном случае вклад сильной кислоты (1,85×10-3) в суммарную кислотность раствора (3,03×10-3) сопоставим со вкладом слабой кислоты (3,03×10-3-1,85×10-3).
Пример 11. Рассчитайте концентрацию ионов водорода в 0,001 М растворе Na2HPO4.
Решение. Для решения в данном случае уместно воспользоваться уравнением
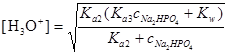 ,
,
содержащим Ka2, Ka3 для Н3РО4, равными 6,34×10-8 и 4,2×10-13 соответственно. Рассматривая выполнимость принимаемых предположений, необходимых для применения упрощенного уравнения, мы видим, что действительно Ka2=6,34×10-8 намного меньше общей концентрации Na2HPO4; следовательно, знаменатель можно упростить. С другой стороны, ни в коем случае нельзя пренебречь величиной Kw по сравнению с Кa3×cNa2HPO4, поскольку первая составляет величину порядка 10-14, а последняя - 4.2×10-14. Таким образом, мы можем применить следующий упрощенный вариант уравнения:
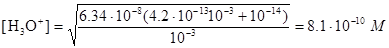
Пример 12. Рассчитайте концентрацию ионов водорода в 0,0100 М растворе NaH2PO4.
Решение. В данном случае необходимыми константами для расчета являются Ka1 и Ka2 для Н3РО4, равные 7,1×10-3 и 6,34×10-8 соответственно. Согласно условию задачи, значение Кa1 сопоставимо со значением cNaH2PO4, поэтому знаменатель в уравнении (см. пример 11) упростить нельзя, но поскольку Ka2cNaH2PO4>Кw, числитель этого уравнения можно упростить до Ka2cNaH2PO4 и найти искомую величину:
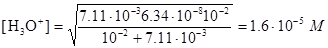
Пример 13. Рассчитайте рН 0,100 М раствора малеиновой кислоты.
Решение. Обозначим малеиновую кислоту Н2М и запишем уравнения диссоциации:
H2M+Н2OÛН3O++НM-, 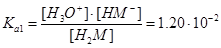
НM-+Н2ОÛН3O++М2-, 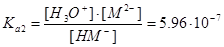 .
.
Пренебрегая диссоциацией H2M по второй стадии, в первом приближении получим
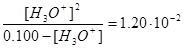 ,
,
[Н3О+]=[HM-]=2,92×10-2, pН= -lg2,92×10-2=1,54.
Из выражения для Ka2 следует, что
[М2-]=5,96×10-7 .
Таким образом, [М2-] намного меньше [НМ-], и сделанное допущение не может внести существенную ошибку в концентрацию ионов водорода.
Пример 14. Рассчитайте концентрацию ионов водорода в 0,0400 М растворе серной кислоты.
Решение. Серная кислота нацело диссоциирует по первой стадии и частично по второй стадии. Если диссоциацией по второй стадии пренебречь, то это означает, что концентрация ионов водорода равна
[H3O+J=[НSО4-]=0,0400 M.
Однако расчет [SO42-] из выражения для Ka2 на основании этого предположения показывает, что
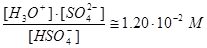 ,
,
т.е. величиной [SO42-] нельзя пренебречь в сравнении с величиной [НSO4-] и требуется более строгое решение.
Из соображений стехиометрии необходимо, чтобы
[H3O+]=0,0400+[SO42-].
Слагаемые в правой части уравнения характеризуют вклад в величину [Н3O+] диссоциации по первой и второй стадии соответственно. После преобразования получим
[SO42-]=[Н3О+]-0,0400.
Условие материального баланса требует, чтобы
cН2SO4=0,0400=[HSO4-]+[SO42-].
Объединяя и преобразуя два последних уравнения, получаем
[HSO4-]=0,0800-[Н3О+].
Подстановка значений [SO42-] и [HSO4-] в выражение для Ka2 дает уравнение
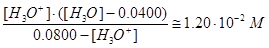 ,
,
решением которого будет [Н3О+]=0,0480 М.
Пример 15. Рассчитайте рН 0,100 М раствора карбоната натрия.
Решение. Необходимо рассмотреть следующие равновесия:
CO32-+H2OÛHCO3-+OH-, 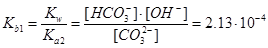 ,
,
HCO3-+H2OÛH2CO3+OH-, 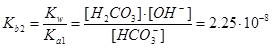 .
.
Если в результате первой реакции количество образующихся ОН- достаточно, чтобы подавить диссоциацию по второму уравнению, то [Н2СO3]<<[НСО3-] и [Н2СО3]<<[СО32-]. Поэтому
[НСО3-]=[ОН-]
[СO32-]=cNa2CO3-[ОН-]»cNa2CO3.
Подставляя найденные значения [HCO3-] и [CO32-] в выражение для Kb1, получим
[ОН-]2=2,13×10-4×10-1=2,13×10-5,
[ОН-]=4,62×10-3 M, рН=14,00-(-lg4,62×10-3)=11,66.
Убедимся, что сделанное допущение не вносит заметной ошибки в значение рН:
[H2CO3]=2.25×10-8
Действительно, [Н2СО3]<<[НСО3-] и [СО32-], и можно показать, что сделанное допущение вносит ошибку менее 5%.
Пример 16. Рассчитайте концентрацию ионов водорода в буферном растворе, содержащем 0,100 М фталевой кислоты (Н2Р) и 0,200 М бифталата калия (КНР).
Решение. Запишем основное равновесие, существующее в растворе:
H2P+H2OÛH3O++HP-, 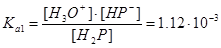 .
.
Пренебрежем диссоциацией Н2Р по второй стадии, т.е. примем, что [Р2-]<<[HP-] и [Р2-]<<[Н2Р]. Тогда
[Н2Р]»cH2P=0,100,
[НР-]»cKHP= 0,200
и
[Н3O+]=5,60×10-4 M.
Расчет [Р2-], проведенный подстановкой [Н+] и [НР-] в выражение для Ka2, показывает, что сделанное допущение вполне оправданно.
Пример 17. Рассчитайте концентрацию ионов водорода в буферном растворе, содержащем 0,0500 М бифталата калия (КНР) и 0,150 М фталата калия (К2Р).
Решение. Запишем уравнение диссоциации фталевой кислоты по второй стадии:
HP +ÛH++P2-, 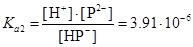 .
.
Полагая, что [Н2Р]<<[НР-] и [Н2Р]<<[Р2-], имеем
[НР-]»cКНР=0,0500 M, [Р2-]»cК2P=0,150 M.
Отсюда
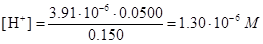
Чтобы проверить правильность первого допущения, вычислим приблизительное значение [Н2Р], подставив в выражение для Ka1 (1.12×10-3) численные значения [Н+] и [HP-]:
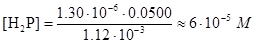
Следовательно, сделанное допущение вполне приемлемо - концентрация Н2Р намного меньше концентраций HP- и Р2-, и диссоциации основания НР- можно пренебречь.
