Глава 2. Электронные представления в органической химии. Элементный анализ органических соединений
Вопросы к семинару
1. Электронное строение атома углерода. Понятие о возбужденном и невозбужденном состояниях.
2. Гибридизация атома углерода. Типы гибридизации и их особенности.
3. Образование и свойства s‑, π‑, τ‑ связей.
4. Электронное строение метана, циклопропана, этилена, ацетилена.
5. Типы разрыва ковалентных связей. Электронное и пространственное строение частиц, образующихся при гомолитическом (свободные радикалы) и гетеролитическом (карбанионы, карбкатионы) разрыве связей. Факторы, определяющие их относительную устойчивость.
Опыты к лабораторной работе
1. Обугливание органических соединений
2. Обнаружение углерода и водорода в органическом веществе
3. Обнаружение азота, серы, галогенов в органическом веществе с помощью пробы Лассеня
4. Определение галогенов по методу Степанова
5. Определение галогенов по методу Бельштейна
Задания к самостоятельной работе
Вариант №1
1. Приведите электронные и электронно-графические формулы атома углерода в основном и в возбуждённом состояниях. Объясните, что такое гибридизация атомных орбиталей. Перечислите типы гибридизации атомов углерода.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество и укажите гибридизацию каждого атома углерода в его молекуле:

3. Дайте определение понятиям: «ковалентные σ-связи», «ковалентные π-связи». Посчитайте их количество в соединении из задания 2 (только углерод-углеродные связи).
4. Какой тип разрыва (гомолитический или гетеролитический) более характерен для связи С–Н в алканах? Ответ обоснуйте, подтвердите схемой на примере этана СН3–СН2–Н.
5. Как называется образующаяся углеводородная частица (задание 4) и каково её электронное и пространственное строение?
Вариант №2
1. Охарактеризуйте положение атома углерода в периодической системе химических элементов Д.И. Менделеева. Объясните, почему углерод четырёхвалентен.
2. Дайте определение понятию «гибридизация атомных орбиталей». Объясните, как определяют тип гибридизации атомов углерода в соединениях. Напишите структурную формулу 3-метилпентина-1 и укажите гибридизацию каждого атома углерода в его молекуле.
3. Какие химические связи называются ковалентными? Объясните, как формируются σ- и π-ковалентные связи. Какие разновидности углерод-углеродных связей (σ- или π-) имеются в 3-метилпентине-1. Подсчитайте их количество.
4. Какой тип разрыва (гомо- или гетеролитический) будет характерен для связи углерод – металл в приведённом веществе. Ответ обоснуйте.
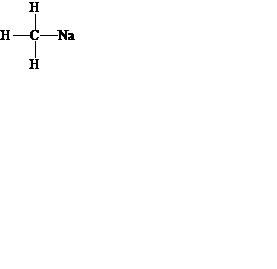
5. Как называется углеводородная частица, образующаяся из вещества в задании 4? Объясните её электронное и пространственное строение.
Вариант №3
1. Гибридизация: определение. Перечислите гибридные состояния атома углерода. Как зависит геометрия молекул от типа гибридизации углеродных атомов?
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество, укажите гибридизацию каждого атома углерода в его молекуле:
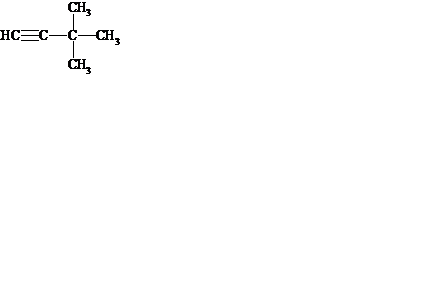
3. Какие ковалентные связи называются «σ-связями» и «π-связями»? Сколько π-связей имеется в соединении из задания 2?
4. Какой тип разрыва связи приведён на схеме? Ответ обоснуйте.

5. Как называется углеводородная частица, образующаяся при разрыве связи (задание 4). Объясните её электронное и пространственное строение.
Вариант №4
1. sp3-Гибридизация: основные особенности, графическое изображение sp3-гибридного атома углерода.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Напишите структурную формулу 2,5-диметилгептадиена-2,4, укажите гибридизацию каждого атома углерода в его молекуле.
3. Укажите в соединении из задания 2 σ- и π-связи. Объясните, как они формируются.
4. Назовите два возможных механизма разрыва ковалентных связей. Объясните, по какому механизму, и по какой причине будет разрываться связь «углерод – бром» в 2-бромпропане.
5. Как называется углеводородная частица, образующаяся при расщеплении связи (задание 4)? Объясните её электронное и пространственное строение.
Вариант №5
1. sp2-Гибридизация: основные особенности, графическое изображение sp2-гибридного атома углерода.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество, укажите гибридизацию каждого атома углерода в его молекуле:
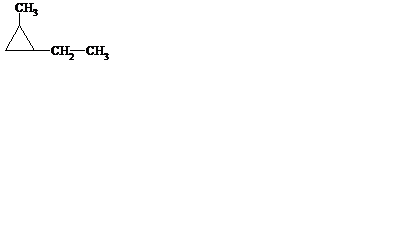
3. Дайте определения понятиям: «π-связи», «σ-связи», «τ-связи». Какие разновидности углерод-углеродных связей (σ-, π-, τ-) содержаться в молекуле вещества из задания 2? Укажите их количество.
4. Какой механизм разрыва связи называется гомолитическим? Объясните, почему углерод-углеродные связи в молекуле циклопропана преимущественно разрываются по этому механизму.
5. Как называются частицы, образующиеся при гомолитическом типе разрыва ковалентной связи? Объясните электронное и пространственное строение такой углеводородной частицы, образующейся из метана.
Вариант №6
1. sp-Гибридизация: основные особенности, графическое изображение sp-гибридного атома углерода.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Напишите структурную формулу 3-метилбутадиена-1,2 и укажите гибридизацию каждого атома углерода в его молекуле.
3. Какие ковалентные связи называются σ-связями? Как они формируются? Какими свойствами обладают? Сколько углерод-углеродных σ-связей содержится в молекуле вещества из задания 2?
4. Какие связи называются ковалентно-полярными? Какая из связей в 2-хлорпропане является самой полярной? Приведите схему её разрыва.
5. Объясните электронное и пространственное строение углеводородной частицы, образующейся в задании 4.
Вариант №7
1. Охарактеризуйте положение атома углерода в периодической системе химических элементов Д.И. Менделеева. Объясните понятия: «атомная орбиталь», «гибридизация орбиталей». Перечислите возможные гибридные состояния атома углерода. Укажите число гибридных и негибридных орбиталей у атома углерода при каждом типе гибридизации.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество, укажите гибридизацию каждого атома углерода в его молекуле:

3. Ковалентная связь: определение. Схемы образования σ- и π-связей. Укажите число σ- и π- углерод-углеродных связей в молекуле вещества из задания 2.
4. Назовите два основных механизма разрыва ковалентных связей. По какому из этих механизмов и по какой причине будет разрываться связь «углерод-металл» в веществе: СН3–СН2–MgCl.
5. Объясните строение углеводородной частицы, образующейся в задании 4.
Вариант №8
1. sp3-Гибридизация: электронное и пространственное строение молекулы метана.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Напишите формулу 3-метилбутина-1. Укажите гибридизацию каждого атома углерода в его молекуле.
3. Какая связь называется ковалентной? Дайте определение основным количественным характеристикам ковалентной связи – длине, энергии, полярности, поляризуемости.
4. Поясните термин «τ-связь» и покажите её образование на примере циклопропана.
5. Известно, что карбкатион имеет плоское строение. Объясните этот факт, изобразите пространственное строение этильного карбкатиона.
Вариант №9
1. Приведите электронные и электронно-графические формулы атомов углерода в основном и в возбуждённом состояниях. Дайте определение понятию «гибридизация орбиталей». Перечислите типы гибридизации, характерные для атомов углерода.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество и укажите гибридизацию каждого атома углерода в его молекуле:

3. Какая ковалентная связь называется «π-связью»? Укажите π-связи в молекуле соединения из задания 2.
4. Поясните термины «карбкатион, карбанион». Приведите схемы их образования на примере этилйодида и этилкалия.
5. Объясните пространственное строение карбионов из задания 4, подтвердите рисунком.
Вариант №10
1. sp2-Гибридизация и строение молекулы этилена. Формирование σ- и π-связей.
2. Как определяют тип гибридизации атомов углерода в соединениях? Напишите формулу 4-метилпентадиена-1,2. Укажите гибридизацию каждого атома углерода в его молекуле.
3. σ- и π-Ковалентные связи: определения. Приведите формулу и название вещества, в молекуле которого содержится три σ- и две π-ковалентные углерод-углеродные связи, укажите эти связи.
4. Какие связи называются ковалентно-полярными и ковалентно-неполярными? Напишите формулу хлорэтана и укажите в его молекуле наиболее полярную ковалентную связь.
5. Поясните понятия «гомолиз», «гетеролиз». Какой из этих механизмов, и почему, характерен для разрыва связи углерод-галоген? Как называется органическая частица, образующаяся в результате этого разрыва?
Вариант №11
1. sp-Гибридизация и строение молекулы ацетилена. Формирование σ- и π-связей.
2. Как определяется тип гибридизации атомов углерода в соединениях? Напишите формулу пропеновой кислоты. Укажите гибридизацию каждого атома углерода в её молекуле.
3. Какая ковалентная связь называется σ-связью? Приведите графическое изображение способов её формирования. Укажите углерод-углеродные σ-связи в молекуле следующего вещества:

4. Поясните понятия «карбкатион», «карбанион», «радикал». Назовите вещество из задания 3, и объясните причину, по которой при разрыве связи –С-ОН образуется карбкатион.
5. Объясните, почему карбкатион имеет плоское строение. Приведите его графическое строение.
Вариант №12
1. Изобразите электронные орбитали sp3, sp2, sp-гибридных атомов углерода. Укажите величину углов между ними и объясните, почему именно такая величина является оптимальной.
2. Как определяют тип гибридизации атомов углерода в соединениях? Назовите вещество, укажите гибридизацию каждого атома углерода в его молекуле:

3. Какие связи называются ковалентными? В чём заключаются обменный и донорно-акцепторный механизмы их образования? Какие разновидности углерод-углеродных связей (σ- или π-) содержатся в молекуле вещества из задания 2. Подсчитайте их количество.
4. Поясните понятия «гомолитический и гетеролитический механизм разрыва ковалентной связи». Какой из этих механизмов и по какой причине реализуется при разрыве связи «углерод-металл» в молекуле бутиллития? Подтвердите схемой.
5. Как называется органическая частица (карбкатион, карбанион или радикал), которая образуется в задании 4? Объясните её электронное и пространственное строение.
Вариант №13
1. sp3-Гибридизация: основные особенности. Графическое изображение sp3-гибридного атома углерода. Участие sp3-гибридных атомов в построении молекулы циклобутана.
2. Объясните, почему при определении типов гибридизации атома углерода достаточно подсчитать число σ- и π-связей, которые он образует.
3. Назовите следующее вещество:
СН3–СН=СН–СН=СН2
Какие разновидности ковалентных связей (σ-, π-, τ-) встречаются в его молекуле? Подсчитайте их количество.
4. Дайте определение понятиям «гомо- и гетероциклический разрыв ковалентных связей». Объясните, почему первый характерен для неполярных связей, а второй – для полярных. Подтвердите схемами.
5. Известно, что карбкатион имеет плоское строение, а карбанион – тетраэдрическое. Объясните этот факт.
Вариант №14
1. Проанализировав строение этилена, объясните, почему: а) каждый атом углерода образует три σ- и одну π-связь; б) молекула плоская; в) вокруг двойной связи невозможно свободное вращение.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Напишите формулу пентадиена-1,2. Укажите гибридизацию каждого атома углерода в его молекуле.
3. Дайте определение понятию σ-связь. Аргументировано объясните, для какой из связей: CSP3–H и CSP–H наиболее характерным будет гомолитический разрыв, а для какой – гетеролитический.
4. Используя ответ на задание 3, приведите схемы разрыва углерод - водородных связей в молекулах метана и ацетилена.
5. Приведите примеры первичного, вторичного и третичного карбкатионов. Расположите их в ряд по уменьшению устойчивости. Ответ объясните.
Вариант №15
1. Проанализировав строение ацетилена, объясните, почему: а) каждый атом углерода образует по две σ- и π-связи; б) молекула линейна; в) связь CSP–H более полярна, чем CSP2–H.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество:

Укажите гибридизацию каждого атома углерода в его молекуле.
3. σ- и τ-Ковалентные связи: определения, способы их формирования. Приведите формулу и название вещества, в молекуле которого содержаться три τ- и шесть σ-связей.
4. Какие связи называются ковалентно-полярными, а какие - ковалентно-неполярными? Напишите формулу метилнатрия и укажите в его молекуле наиболее полярную связь.
5.Поясните понятия «гомолиз», «гетеролиз». Какой из этих механизмов и почему характерен для разрыва связи «углерод - металл»? Как называется органическая частица, образующаяся в результате этого разрыва?
Вариант №16
1. Проанализировав строение бутана, объясните, почему: а) каждый атом углерода образует четыре σ-связи и не образует π-связи; б) молекула зигзагообразна; в) молекула может принимать в пространстве разные геометрические формы.
2. Объясните, как определяют тип гибридизации атомов углерода в соединениях. Назовите вещество:

Укажите гибридизацию каждого атома углерода в его молекуле.
3. Поясните термины «σ-, π-, τ-связи». Какие из этих связей встречаются в соединении из задания 2? Укажите их.
4. Назовите два возможных механизма разрыва ковалентных связей. Объясните, по какому механизму и по какой причине будет разрываться связь CSP3–ОH в спиртах. Подтвердите схемой на примере 2-метилпропанола-2 и пропанола-1.
5. Объясните, почему образовавшиеся углеводородные частицы из задания 4 называются «карбкатионами». Какой из этих карбкатионов и почему наиболее устойчив?
Вопросы для самоконтроля
