Основные законы и понятия химии. Окислительно-восстановительные реакции
1.При нормальных условиях 1 г воздуха занимает объем 733 мл. Какой объем займет та же масса воздуха при 0 С0 и давлении, равном 93,3 кПа (700 мм.рт.ст.)?
2.Расчетным путем покажите, одинаковое ли количество молекул содержится в 1 эквиваленте диоксида серы SO2 и триоксида серы SO3 , взятых при одинаковых условиях.
3.Используя метод электронного баланса, составить схемы процессов окисления и восстановления, полное уравнение реакции в данной схеме:
MoS2 + HNO3 + PbO2 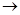 H2MoO4 + PbSO4 + Pb(NO3)2 Если необходимо, впишите недостающие молекулы воды. Укажите окислитель и восстановитель.
H2MoO4 + PbSO4 + Pb(NO3)2 Если необходимо, впишите недостающие молекулы воды. Укажите окислитель и восстановитель.
4.При восстановлении 1,8 г оксида металла израсходовано 833 мл водорода при н.у. Вычислить эквивалент оксида и металла.
5.Определите массу и объем 24,08*1023 молекул сероводорода H2S при 33 С и давлении 1,06кПа.
6.Используя метод электронного баланса составить схемы процессов окисления и восстановления, полное уравнение реакции в данной схеме:
CuFeS2 + HNO3 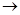 Fe(NO3)3 + CuSO4 + H2SO4 + NO Если необходимо, впишите недостающие молекулы воды. Укажите окислитель и восстановитель.
Fe(NO3)3 + CuSO4 + H2SO4 + NO Если необходимо, впишите недостающие молекулы воды. Укажите окислитель и восстановитель.
7.Давление газа, занимающего объем 2,5 л равно 121,6 кПа. Чему равно давление, если, не изменяя температуру, сжать газ до 1 л?
8.Расчетным путем покажите, одинаковое ли количество молекул в 1 эквиваленте диоксида и оксида азота при одинаковых условиях.
9.Используя метод электронного баланса, расставьте коэффициенты, укажите окислитель и восстановитель.As2S3 + HNO3 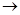 H3AsO4 + NO2 + H2SO4
H3AsO4 + NO2 + H2SO4
10.Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалент металла.
11.Сопоставить число молекул, содержащихся в 1 г H2SO4 с числом молекул, содержащихся в 1 г HNO3 .
12.На основании электронных уравнений реакций расставьте коэффициенты в уравнении реакции, идущей по схеме: Cu2S + Fe2 (SO4)3 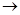 FeSO4 + CuSO4 + S В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
FeSO4 + CuSO4 + S В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
13.На нейтрализацию 2,45 г кислоты идет 2,0 г гидроксида натрия. Определить эквивалентную массу кислоты.
14.Определить массу и объем 3,01* 1023 молекул метана при 22 С и 81,06 кПа.
15.Используя метод электронного баланса, составить процесс окисления и восстановления, полное уравнение реакции в данной схеме: Cr2S3 +HNO3 + PbO2 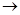 H2Cr2O7 +PbSO4 + Pb(NO3)2 Указать окислитель и восстановитель. Если необходимо, впишите недостающие молекулы воды.
H2Cr2O7 +PbSO4 + Pb(NO3)2 Указать окислитель и восстановитель. Если необходимо, впишите недостающие молекулы воды.
16.На нейтрализацию 0,943 г фосфористой кислоты H PO израсходовано 1,291 г КОН. Вычислите эквивалент кислоты и ее основность.
17.В каком объеме хлора (20 С, 745 мм.рт.ст.) содержится 10 молекул?
18.На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: Fe(CrO2)2 + K2CO3 + O2 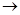 Fe2O3 + K2CrO4 + CO2 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
Fe2O3 + K2CrO4 + CO2 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
19.Напишите уравнения реакций Fe(OH)3 с соляной кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид; б) гидроксохлорид; в) хлорид. Вычислите эквивалент Fe(OH)3 в каждой из этих реакций.
20.Покажите, одинаковы ли количество молекул содержащихся в 1 эквиваленте триоксида серы и сероводорода.
21.На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме: FeS + O2 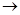 Fe2O3 + SO2 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
Fe2O3 + SO2 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
22.При взаимодействии 1,84 г щелочного металла с водой выделилось 896 мл водорода, измеренного при нормальных условиях. Определить эквивалентные массы металла и образовавшиеся соединения.
23.Какой объем СО2 получается при сгорании 2 л бутана? Объемы этих газов измерены при 27 С и 740 мм.рт.ст.
24.На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме: Cu2S + HNO3 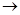 Cu(NO3)2 + H2SO4 + NO В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
Cu(NO3)2 + H2SO4 + NO В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
25.Для растворения 16,8 г металла потребовалось 14.7 г серной кислоты. Определите эквивалентную массу металла и объем выделившегося водорода при 17 С и давлении 740 мм.рт.ст.
26.Вычислите массу одного атома кальция в граммах.
27.На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме: As2S3 + HСlO3 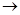 H3 АsO4 + H2SO4 + HCl В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
H3 АsO4 + H2SO4 + HCl В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
28.При нагревании 21,4 г металла было получено 23,4 г оксида. Определите эквивалент металла.
29.Найдите, сколько молекул содержится в 2 молях воды и какой объем они займут при 40С и 105 Па.
30.Используя метод электронного баланса, расставьте коэффициенты, укажите окислитель и восстановитель. As2S3 + H2O2 + NH4OH 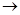 (NH4)3AsO4 + (NH4)2SO4 + H2O
(NH4)3AsO4 + (NH4)2SO4 + H2O
31.Определите эквивалентную массу металла, если 0,3452 его вытесняют из воды водород объемом 180 мл при температуре 15 С и давлении 0,99*105 Па.
32.Какое число молекул содержат 0,01 моля кислорода, 1/50 молей атомов кислорода, 1/25 эквивалентной массы кислорода?
33.На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: NaCrO2 + Br2 + NaOH 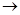 Na2CrO4 + NaBr + H2 + H2O В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
Na2CrO4 + NaBr + H2 + H2O В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
34.Один оксид марганца содержит 22,56% кислорода, а другой 50,50%. Вычислить эквиваленты марганца в этих оксидах и составьте их формулы.
35.Определите, какое количество молекул содержится в 1 мл брома (р=3,1 г/мл)?
36.На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: Cr2Se3 + HNO3 + PbO2 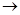 H2Cr2O7 + PbSeO4 + Pb(NO3)2 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
H2Cr2O7 + PbSeO4 + Pb(NO3)2 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
37.Вычислите эквиваленты Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
38.Взяты равные массы кислорода, водорода и метана при 80С и 0,95*105 Па. Найти отношение объемов взятых газов.
39.На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: FeS2 + HNO3 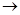 Fe(NO3)3 + NO + H2SO4 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
Fe(NO3)3 + NO + H2SO4 В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
40.Вычислить эквивалент кобальта в соединении его с серой, зная, что на 1 г кобальта приходится 0,545 г серы, валентность которой 2.
41.Рассчитать массу (в граммах) одной молекулы аммиака при 70С и 101,3 кПа.
42.Используя метод электронного баланса, составить уравнения процессов окисления, восстановления, полное уравнение реакции в данной схеме: FeS2 + O2 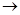 Fe2O3 + SO2 Укажите окислитель, восстановитель. Если необходимо, впишите недостающие молекулы воды.
Fe2O3 + SO2 Укажите окислитель, восстановитель. Если необходимо, впишите недостающие молекулы воды.
43.Магний массой 2 г вытесняет по отдельности 2 л водорода при 170С и 0,99*10 Па, серебро массой 17,7 г и медь массой 10,5 г из соединений этих элементов. Найдите эквивалентные массы этих элементов.
44.Рассчитайте массу ( в граммах) 24,08*1021 молекул сероводорода.
45.На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме: Fe(CrO2)2 + C 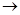 CO + Fe + Cr В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
CO + Fe + Cr В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
