Вторая группа катионов
Групповым реагентом для второй группы катионов является раствор соляной кислоты, осаждающий хлориды серебра, свинца, ртути, отличающиеся по своей растворимости в воде. Нитрат-, нитрит- и ацетат-ионы с катионами второй группы образуют растворимые в воде соли, а с хлорид-, бромид-, иодид-, сульфид-, карбонат-, фосфат-, хромат-, силикат-ионами - малорастворимые соединения.
Общие реакции катионов второй группы
1. Реакция с соляной кислотой, свойства хлоридов.
Растворы HCl и хлоридов осаждают катионы серебра, свинца и ртути по общему уравнению:
Men+ + nCl – = ↓MeCln
Следует избегать большого избытка группового реагента для предотвращения частичного растворения хлоридов вследствие образования комплексов типа: [PbCl3]–, [PbCl4]2–, [AgCl2]–, [HgCl2]–.
Осадок хлорида свинца – кристаллический, белого цвета, частично растворим в холодной воде. Этим пользуются для отделения хлорида свинца от хлоридов серебра и ртути.
Осадок хлорида серебра – белый, творожистый, темнеющий на свету вследствие разложения, в воде практически нерастворим ( 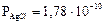 ).
).
Легко растворяется в растворе аммиака:
↓AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–.
Добавление кислоты или иодида калия к полученному аммиачному комплексу смещает равновесие в обратную сторону:
[Ag(NH3)2]+ + 2H+ + Cl– = 2 NH4+ + ↓AgCl,
[Ag(NH3)2]+ + J – = ↓AgJ + 2 NH3 (р-р).
Hg2Cl2 – белый малорастворимый в воде осадок ( 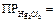 =
= 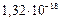 ). Под действием аммиака чернеет вследствие диспропорционирования Hg22+ и выделения металлической ртути:
). Под действием аммиака чернеет вследствие диспропорционирования Hg22+ и выделения металлической ртути:
Hg2Cl2 + 2 NH3(р-р) = ↓HgNH2Cl + ↓Hg0 + NH4+ + Cl –.
Аминохлорид ртути (II) HgNH2Cl – хлорид меркураммония.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям растворов солей Pb2+, Ag+, Hg22+ добавить по 1,5-кратному избытку раствора соляной кислоты. Рассмотреть внешний вид образовавшихся осадков. Разделить каждый на две пробирки и проверить действие нагревания и раствора аммиака. Сделать вывод о разделении катионов II группы на основе свойств хлоридов. Разделить раствор аммиаката серебра на 2 пробирки: в одну прилить раствор HNO3 до кислой реакции, в другую – раствор KJ. Что наблюдается? Объяснить направление происходящих реакций сравнением величин Куст. И ПР соответствующих соединений.
2. Реакции с едкими щелочами.
Растворы едких щелочей с катионами II группы образуют осадки гидроксидов:
Men+ + nOH – = ↓Me(OH)n.
AgOH и Hg2(OH)2 неустойчивы и моментально разлагаются:
2AgOH = Ag2O + H2O,
Hg2(OH)2 = Hg2O + H2O.
Pb(OH)2 обладает амфотерными свойствами и растворяется при действии кислот и щелочей.
↓Pb(OH) 2 + 2H+ = Pb2+ + 2 H2O,
↓Pb(OH) 2 + 2OH – = [Pb(OH)4]2–.
Оксид серебра Ag2O бурого цвета, растворяется в аммиаке с образованием аммиаката [Ag(NH3)2]+. Оксид ртути Hg2O чёрного цвета.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям растворов солей катионов II группы добавлять по каплям раствор NaOH. Наблюдать образование осадков. Изучить действие на них избытка щёлочи и раствора аммиака.
3. Реакция с раствором аммиака.
Раствор аммиака NH3+H2O осаждает катионы свинца и ртути по уравнениям:
Pb2+ + 2 NH3 + 2 H2O = ↓Pb(OH) 2 + 2NH4+,
2 Hg22+ + NH3 + NO3 – + H2O = ↓[Hg2ONH2] NO3 + ↓2Hg + 2OH –.
Катионы серебра при действии раствора аммиака образуют сначала малорастворимый оксид:
2 Ag+ + 2NH3 + H2O = ↓Ag 2O + 2 NH4+,
растворяющийся при дальнейшем добавлении реагента.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям растворов солей катионов II группы добавлять раствор аммиака по каплям. Описать наблюдаемые явления.
4. Реакция с хроматом калия.
K2CrO4 образует с катионами II группы в нейтральной и слабокислой среде малорастворимые осадки хроматов:
2Men+ + nCrO4 2– = Me2(CrO4)n.
PbCrO4 – осадок жёлтого цвета, легко растворимый в щёлочи:
↓PbCrO4 + 4OH – = [Pb(OH)4]2– + CrO42–
Hg2CrO4 – осадок красного цвета, нерастворимый в щелочах и растворе азотной кислоты.
Ag2CrO4 – осадок красно-кирпичного цвета, растворим в растворах азотной кислоты и аммиаке.
В ы п о л н е н и е р е а к ц и и. Получить осадки хроматов катионов II группы, обратить внимание на окраску. Изучить растворимость в растворах HNO3, NaOH, NH3+H2O.
Записать уравнения происходящих реакций.
5. Реакция с иодидом калия.
KJ осаждает катионы II группы в виде малорастворимых соединений. PbJ 2 – осадок золотисто-жёлтого цвета, его растворимость повышается при нагревании. AgJ – осадок бледно-жёлтого цвета, Hg2J 2 – осадок зеленовато-жёлтого цвета, их растворимость при нагревании изменяется мало.
В ы п о л н е н и е р е а к ц и и . Получить осадки иодидов Pb2+, Ag+, Hg22+, изучить действие нагревания на растворимость осадков. В пробирку с PbJ 2 добавить равный объём воды и раствора СН3СООН, нагреть. Осадок растворяется. Погрузить пробирку в холодную воду. Наблюдать выпадение иодида в виде блестящих золотистых кристаллов. Это одна из наиболее красивых аналитических реакций.
6. Реакция с карбонатом натрия.
Карбонат-ионы осаждают катионы II группы в виде малорастворимых осадков, растворяющихся в сильных и слабых кислотах. PbCO3 и Ag2CO3 – белого цвета, Hg 2CO3 – жёлтого. Карбонат серебра растворяется, кроме того, в растворе NH3 и избытке (NH4) 2СО3:
Ag2CO3 + 4 NH4+ + 2CO3 = 2[Ag(NH3)2]+ + 2CO2↑ + 2H2O.
В ы п о л н е н и е р еа к ц и и. Получить осадки карбонатов Pb2+, Ag+, Hg22+, обратить внимание на их окраску, устойчивость, испытать действе HNO3, NH3.
Сделать вывод о растворимости карбонатов.
Характерные реакции катионов свинца
1. Реакция с серной кислотой.
Разбавленная серная кислота и сульфаты осаждают Pb2+ в виде белого кристаллического осадка:
Pb2+ + SO4 2– = ↓PbSO4.
Cульфаты Ag+ и Hg22+ осаждаются только из концентрированных растворов. Осадок PbSO4 растворим при нагревании в щелочах:
↓PbSO4 + 4OH – = [Pb(OH)4]2– + SO42 –.
и в концентрированном растворе ацетата аммония:
2↓PbSO4 + 2CH3COO – = Pb(CH3COO) 2 · PbSO4 + SO4 2–.
Разбавленная азотная кислота повышает частично растворимость PbSO4 за счёт связывания SO42 – в HSO4 –.
В ы п о л н е н и е р е а к ц и и. К 5-6 каплям растворов Pb2+, Ag+, Hg22+ добавить 8-10 капель раствора H 2SO4. Что можно сказать о растворимости сульфатов? Исследовать действие на осадок сульфата свинца NaOH, CH3COONH4, при нагревании. Выписать из справочников по аналитической химии ПР сульфатов катионов II группы. Сделать вывод.
Катионы свинца могут быть выделены из общего раствора с помощью некоторых общеаналитических реакций (HCl, KJ); при нагревании, фильтровании и охлаждении фильтрата выпадают золотисто-жёлтые кристаллы PbJ2.
Характерные реакции катионов ртути
1. Реакция с раствором аммиака.
Это наиболее характерная реакция, позволяющая открыть Hg22+ в присутствии Pb2+ и Ag+. Описание дано в общих реакциях.
2. Восстановление [Hg2]2 до металлической ртути.
а) Соли олова (II) образуют с солями ртути (I) белый осадок Hg2Cl2, чернеющий вследствие восстановления [Hg2]2+ до металлической ртути:
[Hg2]2+ + 2Cl– = ↓Hg2Cl2,
↓Hg2Cl2 + H2[SnCl4] = 2Hg↓ + H2[SnCl6].
В ы п о л н е н и е р е а к ц и и. К капле раствора Hg2(NO3)2 добавить 2-3 капли подкисленного раствора SnCl2. Наблюдать изменение окраски осадка.
б) При действии солей ртути (I) на свободную медь также происходит выделение металлической ртути в виде серого пятна:
Hg22+ + Cu = Cu2+ + 2Hg↓.
В ы п о л н е н и е р е а к ц и и. Поместить каплю раствора Hg2(NO3)2 на блестящую медную пластинку или монету и дать постоять. Через 2-3 минуты смыть раствор водой и потереть пятно фильтровальной бумагой. Что наблюдается?
Характерные реакции для катионов серебра
1. Для отделения катионов серебра от катионов свинца и ртути пользуются характерными свойствами хлорида серебра растворяться в избытке раствора аммиака с образованием комплексного иона [Ag(NH3)2]+:
↓AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–.
