Озы внутривенных АМП для эмпирической АБТ НП (включая позднюю ВАП или при наличии факторов риска ПРВ) у взрослых пациентов с нормальной функцией почек и печени.
| Цефалоспорины без антисинегнойной активности | |
| Цефотаксим | 1-2 г 3 раза в сутки |
| Цефтриаксон | 1-2 г 1 раз в сутки |
| Цефалоспорины с антисинегнойной активностью | |
| Цефепим | 2 г 2 раза в сутки |
| Цефтазидим | 2 г 3 раза в сутки |
| Цефоперазон | 2-3 г 2-3 раза в сутки |
| Карбапенемы | |
| Имипенем | 0,5 г 4 раза в сутки |
| Меропенем | 0,5 г 4 раза в сутки или 1 г 3 раза в сутки |
| Эртапенем | 1 г 1 раз в сутки |
| Ингибиторозащищённые b-лактамы | |
| Амоксициллин/клавуланат | 1,2 г 3-4 раза в сутки |
| Ампициллин/сульбактам | 1,5 г 3-4 раза в сутки |
| Пиперациллин/тазобактам | 2,25 - 4,5 г 3-4 раза в сутки |
| Тикарциллин/клавуланат | 3,1 г 3-4 раза в сутки |
| Цефоперазон/сульбактам | 2-4 г 2-3 раза в сутки |
| Другие b-лактамы | |
| Азтреонам | 1-2 г 3-4 раза в сутки |
| Аминогликозиды | |
| Гентамицин | 5 мг/кг в сутки* |
| Амикацин | 15-20 мг/кг в сутки* |
| Фторхинолоны без антисинегнойной активности | |
| Моксифлоксацин | 400 мг 1 раз в сутки |
| Фторхинолоны с антисинегнойной активностью | |
| Ципрофлоксацин | 600 мг 2 раза в сутки или 400 мг 3 раза в сутки |
| Левофлоксацин | 500-750 мг 1 раз в сутки |
| Препараты с активностью против MRSA | |
| Ванкомицин | 15 мг/кг 2 раза в сутки ** |
| Линезолид | 600 мг 2 раза в сутки |
* Остаточные концентрации гентамицина и амикацина должны быть, соответственно, <1 мкг/мл и <4-5 мкг/мл
** Остаточные концентрации ванкомицина должны быть 15-20 мкг/мл
В начале лечения большинство пациентов с НП должны получать АМП внутривенно. В дальнейшем у пациентов с клинической эффективностью терапии и без нарушения функции ЖКТ возможно пероральное назначение препаратов, обладающих хорошей биодоступностью (например, фторхинолонов и линезолида) – т.н. «ступенчатая» терапия.
Перспективным подходом также является назначение бета-лактамов методом постоянной инфузии, что имеет определенные фармакокинетические, экономические и, возможно, клинические преимущества перед традиционным интермиттирующим введением.
В последние годы также появляются данные об аэрозольном пути введения некоторых препаратов, в частности аминогликозидов и полимиксина Б. Несмотря на теоретические преимущества подобного подхода (более высокие концентрации в лёгочной ткани и пр.) и отдельные сообщения об эффективности в отношении полирезистентных P. aeruginosa (для полимиксина Б), требуется получение более достоверных доказательств для определения возможности широкого клинического применения данного пути введения.
Длительность терапии
Традиционно рекомендуемая длительность терапии НП составляла 14-21 день. В то же время было показано, что при ВАП значительное клиническое улучшение наблюдалось в течение первых 6 дней терапии, а увеличение её длительности до 14 дней приводило к колонизации P. aeruginosa и микроорганизмами семейства Enterobacteriaceae [33].
В исследовании, проведенном с использованием оценки состояния пациентов с ВАП по шкале CPIS в динамике, было показано, при назначении адекватной терапии заметное улучшение наблюдалось к 3-5 дню терапии, что было подтверждено соответствующими изменениями показателя PаО2/FiO2, достоверно лучшими, чем в группе пациентов с неэффективностью терапии [34, 35].
Возможность сокращения длительности терапии НП подтверждается и результатами многоцентрового рандомизированного контролируемого исследования, показывающими, что назначение адекватной эмпирической терапии в течение 8 и 15 дней у пациентов с ВАП приводило к одинаковой эффективности лечения [36].
В одном из недавно завершенных рандомизированных контролируемых исследований за счет внедрения тактики быстрой (в течение 48 ч) отмены антибиотиков у пациентов с ВАП при разрешении клинических симптомов инфекционного поражения легких удалось сократить длительность лечения до 5,8 дней при пневмонии, вызванной грам(-) бактериями, даже несмотря на выделение резистентных штаммов этих микроорганизмов [37].
Оценка эффективности терапии
Клиническая оценка эффективности базируется на динамике таких показателей, как лихорадка, количество и характер мокроты, лейкоцитоз или лейкопения, оксигенация крови, рентгенологическая картина, данные оценки состояния других органов и систем. Клиническое улучшение обычно отмечается через 48-72 ч. после начала терапии, поэтому стартовую терапию НП в течение этого периода времени в большинстве случаев менять не следует. Исключение составляют случаи прогрессирующего ухудшения состояния или получение результатов микробиологического исследования, требующих изменения АБТ.
Рентгенография органов грудной клетки имеет ограниченную ценность при оценке динамики тяжёлой НП, так как при этом часто отмечается первоначальное рентгенологическое ухудшение, особенно у пациентов с бактериемией или инфекцией, вызванной высоковирулентными микроорганизмами. Кроме этого, у пожилых пациентов и лиц с сопутствующими заболеваниями (например, ХОБЛ) рентгенологическое разрешение значительно отстает от клинического улучшения.
Прогностически неблагоприятными рентгенологическими признаками являются: поражение новых долей легкого, увеличение размера инфильтрата более чем на 50% в течение 48 ч., появление очагов деструкции, наличие большого плеврального выпота.
Существенную помощь в клинической оценке динамики состояния пациента с НП может оказать использование шкалы CPIS [17].
Коррекция антибиотикотерапии
При клинической неэффективности лечения НП или после получения результатов микробиологического исследования может потребоваться коррекция эмпирической АБТ.
Таблица 11.
Выбор АМП для лечения НП установленной этиологии
| Микроорганизм | Препараты выбора | Альтернативная терапия |
| E. coli (БЛРС-) | ЦС III-IV поколения или ИЗП или ФХ | Карбапенемы |
| E. coli (БЛРС+) | Карбапенемы | ФХ или цефоперазон/сульбактам  АГ АГ |
| K. pneumoniae (БЛРС-) | ЦС III-IV поколения или ИЗП или ФХ | Карбапенемы  АГ АГ |
| K. pneumoniae (БЛРС+) | Карбапенемы | ФХ или цефоперазон/сульбактам  АГ АГ |
| Enterobacter spp. Morganella spp. Serratia spp. | Цефепим | Карбапенемы  АГ ФХ АГ ФХ  АГ АГ |
| P. aeruginosa | Цефепим или цефтазидим или цефоперазон  АГ или ципрофлоксацин или левофлоксацин АГ или ципрофлоксацин или левофлоксацин | Ципрофлоксацин или левофлоксацин или карбапенемы  АГ АГ |
| Acinetobacer spp. | Цефоперазон/сульбактам или карбапенемы  АГ АГ | Цефепим или цефтазидим или ФХ  АГ АГ |
| S. maltophilia | Ко-тримоксазол | Тикарциллин/клавуланат |
| Метициллиночувствительный S. aureus (MSSA) | Оксациллин, цефазолин, амоксициллин/клавуланат | ФХ или клиндамицин |
| Метициллино-резистентный S. aureus (MRSA) | Линезолид | Ванкомицин или ко-тримоксазол + рифампицин или ФХ |
| S. pneumoniae | Цефотаксим или цефтриаксон или цефепим | Левофлоксацин или моксифлоксацин или амоксициллин/клавуланат |
| Legionella spp. | Ципрофлоксацин, левофлоксацин или моксифлоксацин | Эритромицин + рифампицин |
Использованные сокращения: АГ - аминогликозиды; БЛРС - бета-лактамазы расширенного спектра; ИЗП - ингибиторозащищённые пенициллины; ФХ – фторхинолоны; ЦС – цефалоспорины.
Препараты и их комбинации, рекомендуемые для терапии НП, вызванной наиболее частыми возбудителями, представлены в табл. 11.
Однако, микробиологические критерии, указывающие на необходимость изменения терапии, четко не определены. Следует помнить, что проводимая терапия должна изменяться только в том случае, если не отмечается клинического улучшения состояния пациента.
Де-эскалация терапии
Кроме этого, терапия может быть изменена на антибиотики более узкого спектра, если не выделены возбудители, против которых была направлена эмпирическая терапия (например, P. aeruginosa, Acinetobacter spp.), или в том случае, если выделенный возбудитель чувствителен к препаратам с более узким спектром активности (например, выделена E. coli, чувствительная к амоксициллину/клавуланату, при эмпирическом назначении карбапенема).
Подобная тактика, получившая название де-эскалации терапии, в настоящее время является общепризнанной при лечении различного рода инфекций, в том числе НП [38]. Основным затруднением в данном случае является скорость получения результатов бактериологического исследования и оценка этиологической роли микроорганизмов, выделенных из нестерильных локусов (мокрота, эндотрахеальный аспират и пр.).
Де-эскалация терапии на основании результатов количественного микробиологического исследования эндотрахеального аспирата или материала, полученного при бронхоскопии (БАЛ или с использованием ЗЩ), оказалась возможной в 31,4% случаев, причем способ получения материала не оказывал влияния на возможность смены АБТ [39].
Де-эскалация терапии, во многом, определяется структурой возбудителей НП и их резистентностью. Так, де-эскалацию удалось провести только в 2,7% случаях при выделении из респираторных образцов грам(-) неферментирующих бактерий (таких как P.aeruginosa и Acinetobacter spp.) и в 49,3% - при обнаружении других возбудителей [39].
Другим вариантом де-эскалации терапии является назначение пациентам с поздней НП, с факторами риска наличия ПРВ и с ВАП стартовой комбинированной терапии, включающей три АМП, перекрывающих широкий спектр наиболее вероятных возбудителей. В последующем, на основании предварительных микробиологических данных проводится отмена отдельных препаратов. Так, при внедрении подобной тактики у пациентов с ВАП удалось в течение первых 48 часов терапии провести отмену одного препарата - у 36,5% и двух – у 61,5% пациентов. При этом такая высокая частота де-эскалации АБТ была достигнута, несмотря на то, что в 25% случаев были выделены штаммы P.aeruginosa и в 15,4% - MRSA, и не привела к ухудшению результатов лечения (в сравнении с историческим контролем). В данном исследовании также удалось добиться сокращения длительности терапии до 8,6 дней (в контрольной группе – 14,8 дней) [40].
Однако предварительный анализ данных исследования ALARM, в котором отслеживались все случаи изменения АБТ при лечении пациентов с ВАП, привел к менее оптимистичным результатам. Оказалось, что в целом де-эскалация терапии проводилась нечасто – менее чем в 20% случаев. Эскалация (т.е. «усиление» терапии, расширение ее спектра) была отмечена почти с такой же частотой – в 15% случаев. Возможно, это связано с тем, что в данном исследовании наиболее часто ВАП была вызвана P.aeruginosa, что было также основной причиной необходимости эскалации режима терапии. Следует отметить, что в группе пациентов, которым потребовалась эскалация режима терапии, летальность составила почти 50%, в сравнении с 16% среди пациентов, у которых была проведена де-эскалация (p = 0,001) [41]. Это является еще одним косвенным подтверждением несомненной необходимости начинать эмпирическую терапию ВАП с режима, перекрывающего широкий спектр наиболее вероятных возбудителей.
Проблемой проведения де-эскалации в России являются сложности с достоверным определением чувствительности к АМП в микробиологических лабораториях. Возможность использования этого метода оптимизации АБТ определяется наличием в структуре лечебного учреждения лаборатории, регулярно проводящей внутренний контроль и участвующей в программах внешней оценки качества.
Учитывая объективные трудности дифференциальной диагностики при обнаружении инфильтративных изменений в легких, особенно у пациентов ОРИТ, а также бесспорную важность раннего назначения адекватной АБТ в случае НП, в рандомизированном клиническом исследовании был предложен рациональный практический подход к назначению АМП у данного контингента пациентов. Путем исходной оценки состояния пациентов по шкале CPIS (< 6 баллов) была выделена группа пациентов с низкой вероятностью ВАП. Результаты лечения оказались одинаковыми при назначении антибиотиков коротким курсом (в течение 3 дней) и при проведении «классической» терапии антибиотиками в течение 10-21 дней, причём, в первой группе частота суперинфекций ПРВ была достоверно ниже [33]. Подобный подход позволяет существенно сократить затраты на АМП и уменьшить риск возникновения резистентности.
Таким образом, клиническая оценка состояния пациента в динамике является основным критерием для решения вопроса о необходимости/возможности изменения или прекращения антибактериальной терапии (рис.3) [3].
Исходы НП
Исход терапии НП может определяться по клиническим и микробиологическим критериям. С клинической точки зрения может отмечаться улучшение, разрешение, замедленное разрешение, рецидив, неэффективность терапии и летальный исход.
Исход лечения НП с микробиологических позиций оценивается по результатам микробиологического исследования образцов клинического материала, полученных из дыхательных путей.
Рисунок 2.
Тактика ведения пациента с подозрением на НП (включая ВАП) [3]
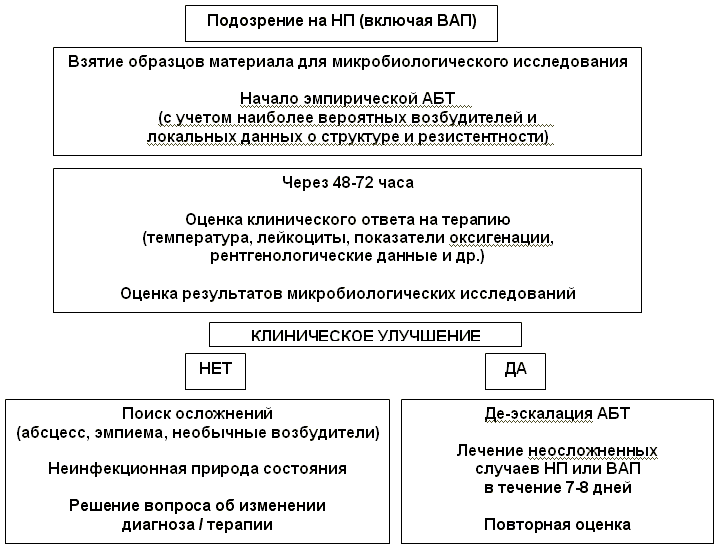
Используются следующие категории оценки: эрадикация, суперинфекция (появление нового возбудителя), рецидив (элиминация с последующим появлением первоначального возбудителя) или персистенция.
Выводы
1. При подозрении на НП следует немедленно начать адекватную эмпирическую АБТ, так как отсрочка в назначении адекватного лечения сопровождается ухудшением прогноза (степень доказательности I и II).
2. Для обеспечения максимальной эффективности эмпирической терапии пациентов с тяжёлой НП критически важным является использование АМП в адекватных дозах (степень доказательности I и II).
3. Для эмпирической терапии НП АМП должны назначаться внутривенно. В дальнейшем у пациентов с клиническим улучшением и нормальной функцией ЖКТ возможен переход на пероральную терапию с использованием антибиотиков с хорошей биодоступностью (степень доказательности II и III).
4. Использование арозольного пути введения не повышает эффективности терапии ВАП, однако, он может применяться в качестве дополнительной терапии у пациентов с НП, вызванной полирезистентными грам(-) микроорганизмами, и неэффективностью системной АБТ (степень доказательности I и II).
5. Рекомендуется использование комбинированной терапии у пациентов с высокой вероятностью НП, вызванной ПРВ. Однако, недостаточно данных по преимуществам данного подхода перед монотерапией (за исключением повышения вероятности адекватности эмпирической терапии) (степень доказательности II и III).
6. В случае использования аминогликозидов для эмпирической терапии, их применение может быть прекращено через 5-7 дней у пациентов с клинической эффективностью лечения (степень доказательности II и III).
7. Возможно использование отдельных АМП в виде монотерапии у пациентов с тяжёлой НП и ВАП и низкой вероятностью ПРВ. Пациенты с вероятностью НП, вызванной ПРВ, эмпирически должны получать комбинированную терапию до получения результатов микробиологических исследований (степень доказательности I и II).
8. При эффективной эмпирической АБТ, её длительность может быть сокращена до 7 дней (степень доказательности I и II).
9. При клинической эффективности лечения и получении микробиологических данных об этиологии инфекции у пациента и чувствительности выделенных возбудителей возможна де-эскалация АБТ (степень доказательности II).
| XIII. ПРОФИЛАКТИКА НП Принимая во внимание факторы риска и патогенез НП, очевидно, что профилактика должна включать в себя комплекс взаимосвязанных мероприятий организационного, технического и медицинского характера, снижающих вероятность контаминации и инфицирования, усиливающих антиинфекционную защиту самого пациента. При этом относительно простые подходы и манипуляции способны существенно уменьшить риск развития НП. Некоторые основные мероприятия, направленные на предупреждение модифицируемых факторов риска с целью профилактики возникновения НП, имеющие наиболее высокую степень обоснованности, приведены ниже [3, 44]. 1. Общие рекомендации • Строгое выполнение мероприятий по инфекционному контролю, обучение персонала и соблюдение правил дезинфекции рук с использованием спиртосодержащих антисептиков для уменьшения риска перекрестного инфицирования. • Эпидемиологический надзор за инфекциями в ОРИТ для выявления и оценки распространенности полирезистентных возбудителей, а также своевременное и регулярное информирование клиницистов о полученных данных. Для контроля распространённости НП следует ориентироваться на стандартизованные показатели и рассчитывать её на 100 койко-дней или на 1000 дней ИВЛ. • Обеспечение адекватного количества персонала в ОРИТ для повышения качества инфекционного контроля, снижения риска развития нозокомиальных инфекций и уменьшения продолжительности госпитализации. • Приподнятое положение (30-45о) головного конца кровати пациента, особенно при проведении энтерального питания [42, 43]. • Энтеральное питание является более предпочтительным, чем парентеральное, так как позволяет уменьшить риск развития осложнений, связанных с центральным венозным катетером, и предупредить атрофию слизистой оболочки кишечника, которая может повышать риск инфекции. • Тщательное наблюдение, ограниченное использование и своевременное удаление всех инвазивных устройств. • Эффективная программа контроля за применением АМП, основанная на локальных микробиологических и эпидемиологических данных, направленная на уменьшение селективного давления и снижение риска колонизации и инфекции полирезистентными микроорганизмами. 2. Рекомендации по проведению интубации и ИВЛ • Исключение случаев необоснованной интубации. • Неинвазивная вентиляция с положительным давлением с использованием лицевой маски или шлема может с успехом использоваться у некоторых пациентов с ХОБЛ и застойной сердечной недостаточностью. • Оротрахеальная интубация является более предпочтительной, чем назотрахеальная, с точки зрения предупреждения нозокомиального синусита и снижения риска возникновения ВАП (хотя прямая связь пока не доказана). • Давление в манжете интубационной трубки должно быть выше 20 см вод.ст. • При проведении ИВЛ контролируемый объем не должен превышать 6 мл/кг, что позволяет уменьшить повреждение легких, особенно у пациентов с ОРДС. • Уменьшение длительности интубации и механической вентиляции, используя протоколы по оптимизации использования седативных средств и быстрому отказу от ИВЛ. • Постоянная аспирация секрета из подсвязочного пространства. 3. Рекомендации по оборудованию для респираторной терапии • Надлежащая дезинфекция и стерилизация оборудования для проведения респираторной терапии и бронхоскопов для уменьшения перекрестного инфицирования. • Удаление контаминированного конденсата из дыхательного контура. • Использование пассивных увлажнителей для снижения колонизации дыхательного контура. Замена дыхательных контуров не рекомендуется. 4. Применение АМП и других лекарственных препаратов • Профилактика НП путем перорального назначения неабсорбируемых АМП, а также их комбинации с системным введением (селективная деконтаминация кишечника – СДК) должна использоваться только у некоторых категорий пациентов (например, с травмой), и не рекомендуется для рутинного использования. • Профилактическое назначение цефуроксима во время интубации может использоваться для предупреждения развития НП в ОРИТ у пациентов с закрытой травмой головы. • Применение хлоргексидина для уменьшения степени орофарингеальной колонизации. • Рациональное назначение седативных препаратов, наркотических анальгетиков, миорелаксантов, антацидов значимо сокращает частоту развития НП, за счёт ограничения процесса транслокации микрофлоры в дыхательные пути. • При наличии показаний для профилактики стрессового кровотечения рекомендуется назначение Н2-блокаторов (препараты выбора) или сукральфата. 5. Смешанные факторы риска • Переливания эритромассы и других аллогенных препаратов крови должны проводиться ограниченно, при наличии строгих показаний. • У пациентов ОРИТ рекомендуется проведение интенсивной инсулинотерапии, направленной на поддержание уровней глюкозы сыворотки крови в пределах от 80 (4,44) до 110 (6,11) мг/дл, для снижения длительности ИВЛ, госпитализации, частоты заболеваемости и летальности. При обучении персонала правилам ухода за пациентами с нарушенным сознанием и бульбарными расстройствами, получающими респираторную поддержку, небулайзерную терапию, энтеральное питание, обязательно должны рассматриваться такие важные практические моменты профилактики НП, как необходимость соблюдения угла наклона головного конца кровати, периодического контроля положения желудочного зонда, перистальтики и усвоения вводимой смеси, давления в манжете эндотрахеальной или трахеостомической трубки, обработки кожного покрова. Предупреждению переноса бактерий персоналом способствует правильная организация обработки рук: использование жидкого мыла, антисептиков и одноразовых салфеток. Рекомендуется мытьё рук перед надеванием и после снятия чистых перчаток с их сменой у каждого пациента, что позволяет предотвратить перекрёстную контаминацию. Необходимо выявление и санация носительства MRSA среди персонала лечебных учреждений, например, с помощью мупироцина. Весьма действенной мерой является изоляция пациентов с инфекционными заболеваниями и организация помощи в ОРИТ по принципу «один пациент – одна сестра». Такая тактика особенно оправдана при инфекциях, вызванных полирезистентными бактериями (например, MRSA). Проведение респираторной терапии или ИВЛ должно предусматривать неукоснительное соблюдение принципов асептики и антисептики медицинским персоналом, а именно: использование одноразовых стерильных расходных материалов, контактирующих с дыхательными путями пациента; ежедневная стерилизация небулайзеров; смена увлажнителей при контаминации; своевременное удаление конденсата из дыхательного контура; использование стерильных растворов для небулайзерной терапии, увлажнения воздуха и пр.; стерилизация многоразовых дыхательных контуров перед их использованием у нового пациента (частая замена контура у одного пациента не рекомендуется); тщательная аспирация секрета из надманжеточного пространства с промыванием катетеров только стерильными растворами; смена ёмкости для сбора аспирата перед использованием у другого пациента. Системное назначение АМП с целью профилактики НП у пациентов с факторами риска, в том числе находящихся на ИВЛ, не имеет аргументированных доказательств эффективности. Назначение цефалоспоринов I-III поколения, снижая риск ранней НП, одновременно служит фактором, способствующим развитию поздней НП, вызываемой неферментирующими грам(-) бактериями и MRSA. Рекомендации экспертов по обязательному назначению антибиотиков с целью профилактики ВАП у больных без исходного инфекционного процесса бактериальной природы отсутствуют. В основу принятия индивидуального решения должны быть положены характер основной и сопутствующей патологии, прогнозируемая длительность ИВЛ и наличие риска аспирации на догоспитальном этапе при нарушениях сознания. Сочетание системного назначения АМП с СДК сопровождается статистически значимым снижением числа инфекций нижних отделов дыхательных путей и летальности в общей популяции пациентов ОРИТ, находящихся на ИВЛ (категория доказательности I). Классическая схема СДК ЖКТ основана на сочетании энтерального (через зонд) назначения неабсорбируемых антибиотиков (аминогликозиды и полимиксин) с амфотерицином В, обработки ротоглотки 2% пастой, содержащей эти препараты и парентеральном введении антибиотиков широкого спектра действия (цефалоспорины III поколения или ципрофлоксацин). Главная роль СДК – предотвращение избыточной колонизации ротоглотки и кишечника грамотрицательными аэробами и, следовательно, профилактика первичного и вторичного эндогенного инфицирования. Влияние СДК на снижение летальности в группе больных терапевтического профиля не доказано. Возможно, отсутствие снижения летальности у соматических пациентов было связано со значительно меньшей обратимостью основного патологического процесса (острые нарушения мозгового кровообращения, декомпенсация хронической сердечной недостаточности, острая печёночная недостаточность и др.), а также выведением из анализа некоторых категорий хирургических больных, в том числе с высоким риском развития осложнений (операции на пищеводе и сердце, трансплантация печени). В целом, проведение СДК можно рекомендовать отдельным категориям хирургических больных с высоким риском развития ВАП, но потенциально обратимым основным патологическим процессом (например, с политравмой, изолированной черепно-мозговой травмой, абдоминальным сепсисом). Применение СДК в качестве обязательного стандарта профилактики не оправдано как с экономической точки зрения, так и с позиций экологических последствий для данного ОРИТ. Риск развития НП может быть снижен посредством проведения деконтаминации ротоглотки с использованием антисептиков (в частности, геля, содержащего 2% хлоргексидина). Введение этого препарата в буккальное пространство пациентам четыре раза в сутки в течение всего периода проведения ИВЛ приводило к снижению степени ежедневного риска развития ВАП (в сравнении с плацебо) до 65% (категория доказательности II). Следует отметить, что применение комбинированного геля, содержащего 2% хлоргексидина и 2% колистина, хотя и приводило к повышению эффективности деконтаминации ротоглотки, особенно в отношении уменьшения степени обсемененности грамотрицательными бактериями, однако не улучшало результаты профилактики ВАП [45]. |
| Характер ошибки | Комментарий |
| Неправильная интерпретация очагово-инфильтративных изменений в лёгких на рентгенограмме | Возможными неинфекционными причинами являются: новообразования, тромбоэмболия лёгочной артерии и инфаркт лёгкого, застойная сердечная недостаточность, ОРДС, ателектаз, лекарственная пневмопатия. Главным определяющим моментом служит оценка динамики клинико-лабораторных признаков, общего состояния пациента и микробиологическая диагностика. Для объективизации оценки клинических, лабораторных и рентгенологических данных у пациентов с подозрением на ВАП целесообразно использовать шкалу CPIS (см. табл. 3). |
| Неверная оценка результатов микробиологического исследования | 1) Отсутствие микроскопической оценки качества мокроты 2) Неправильная интерпретация результатов микробиологического исследования крови 3) Диагностическая значимость выделенных микроорганизмов определятся их концентрацией и способом забора материала (ЭТА - ? 106 КОЕ/мл; БАЛ - > 104 КОЕ/мл; ЗЩ - ? 103 КОЕ/мл) |
| Технические ошибки | Введение катетера или ЗЩ в интактные отделы лёгких искажает истинную микробиологическую картину |
Таблица 13.
Ошибки АБТ НП
| Характер ошибки | Комментарий |
| По выбору схемы АМП | |
| Назначение препаратов для эрадикации диагностически незначимых микроорганизмов | S. viridans, Enterococcus spp., S. epidemidis не являются возбудителями НП. Грибы рода Candida не являются этиологическим агентом НП у пациентов без наличия иммунодефицита. |
| Назначение препаратов с антианаэробной активностью | Роль анаэробов в развитии НП остаётся неясной |
| Назначение гентамицина, карбенициллина, цефалоспоринов I поколения | Активность гентамицина, карбенициллина, цефалоспоринов I поколения в отношении возбудителей НП в России является крайне низкой |
| Использование монотерапии ципрофлоксацином или цефалоспоринов I-III поколения без антисинегнойной активности для стартовой эмпирической терапии ВАП у пациентов ОРИТ | Высокий уровень устойчивости наиболее вероятных возбудителей НП к указанным препаратам (P.aeruginosa, Acinetobacter spp., K.pneumoniae) |
| Назначение цефалоспоринов I-IV поколений для терапии НП, вызванной K.pneumoniae (БЛРС+), по недостоверным результатам определения чувствительности | Снижение чувствительности выделенного штамма K.pneumoniae хотя бы к одному цефалоспорину III поколения позволяет заподозрить продукцию БЛРС |
| По режиму дозирования | |
| Назначение ципрофлоксацина в низких дозах | Из-за роста резистентности возбудителей НП ципрофлоксацин должен назначаться в дозах не менее 800-1200 мг/сутки внутривенно капельно. |
| Низкие дозы антибиотиков при терапии НП, вызванной P.aeruginosa | В связи с высоким значением МПК для большинства АМП и риском селекции резистентности рекомендуются следующий режим дозирования: - цефоперазон 4 г х 3 раза в сутки или 3 г х 4 раза в сутки - цефтазидим 2 г 3 раза в сутки; - имипенем 0,5 г 4 раза в сутки; - меропенем 0,5 г 4 раза в сутки или 1 г 3 раза в сутки; - цефепим 2 г 2 раза в сутки; - ципрофлоксацин 400 мг 3 раза в сутки или 600 мг 2 раза в сутки - левофлоксацин 500-750 мг 1 раз в сутки |
| По длительности терапии | |
| Неоправданно частая смена АМП в процессе лечения | Показаниями для смены АМП служат: - отсутствие клинической эффективности в течение 72 ч и персистенция возбудителя - развитие серьёзных нежелательных явлений - появление возбудителя НП, резистентного к используемому препарату |
| Продолжение использования АМП до нормализации температуры тела, числа лейкоцитов в периферической крови | Разрешение отдельных клинико-лабораторных (субфебрилитет, отделение гнойной мокроты, палочкоядерный сдвиг менее 10) или рентгенологических изменений не совпадает по времени с эрадикацией возбудителя и не является показанием для продолжения АБТ. Основной критерий отмены – обратное развитие комплекса клинической симптоматики, включая регресс дыхательной недостаточности. |
Преодоление проблем, связанных с диагностикой НП, возможно путем улучшения междисциплинарного взаимодействия. Лечащий врач является центральной фигурой, принимающей решения на основании интеграции всей информации о пациенте, касающейся основного заболевания, тяжести и динамики гомеостатических расстройств, факторов риска развития инфекционных осложнений, ответа на терапию.
Важнейшей составляющей такой «информационной системы» служит набор данных о распространённости нозокомиальных инфекций, их этиологической структуре, уровне и профилях резистентности возбудителей.
XV. СПИСОК ЛИТЕРАТУРЫ
1. Tablan О.С., Anderson L.J., Besser R., et al. Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee: guidelines for preventing health-care-associated pneumonia, 2003. Mortal Morbid Wkly Rep 2004; 53(RR-3); 1-36.
2. Hospital-acquired Pneumonia Guideline Committee of the American Thoracic Society & Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired pneumonia, ventilator-associated pneumonia, and healthcare-associated pneumonia — 2005. Am J Respir Crit Care Med 2005. (в печати).
3. Craven D.E., Palladino R., McQuillen D.P. Healthcare-associated pneumonia in adults: management principles to improve outcomes. Infect Dis Clin N Am 2004; 18:939-962.
4. American Thoracic Society. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention. Am J Respir Crit Care Med 2001; 163:1730-1754.
5. Kollef M.H. Prevention of hospital-associated pneumonia and ventilator-associated pneumonia. Crit Care Med 2004; 32:1396-1405.
6. Гельфанд Б.Р., Белоцерковский Б.З., Проценко Д.Н. Нозокомиальная пневмония в хирургии. Методические рекомендации РАСХИ. М., 2003.
7. Fabregas N., Ewig S., Torres A., et al. Clinical diagnosis of ventilator associated pneumonia revisited: comparative validation using immediate post-mortem lung biopsies. Thorax 1999; 54:867-873.
8. Heyland D.K., Cook D.J., Griffith L., et al. The attributable morbidity and mortality of ventilator-associated pneumonia in critically ill patients. Am J Crit Care Med 1999; 159:1249-1256.
9. Rello J., Ollendorf D.A., Oster C., et al. Epidemiology and outcomes of ventilator-associated pneumonia in a large US database. Chest 2002; 122:2115-2121.
10. Kollef M.H. The importance of appropriate initial antibiotic therapy for hospital-acquired infections. Am J Med. 2003; 115: 582-584.
11. Hubmayr R.D. Statement of the 4th International Consensus Conference in Critical Care in ICU-Acquired Pneumonia, Illinois, May, 2002. Intensive Care Med 2002; 28:1521-1536.
12. Sirvent J.M., Torres A., Vidaur L., et al. Tracheal colonisation within 24h of intubation in patients with head trauma: risk factor for developing early-onset ventilator-associated pneumonia. Intensive Care Med 2000; 26:1369-1372.
13. Drakulovic M.B., Torres A., Bauer T.T., et al. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomised trial. Lancet 1999; 354:1851-1858.
14. Ibrahim E.H., Mehringer L., Prentice D., et al. Early versus late enteral feeding of mechanically ventilated patients: results of a clinical trial. J Parenter Enteral Nutr 2002; 26:174-181.
15. Craven D. E., Driks M.R. Nosocomial pneumonia in the intubated patient. Semin Respir Infect 1987; 2:20-33.
16. Heyland D.K., Drover G.W., MacDonald S., et al. Effect of postpyloric feeding on gastroesophageal regurgitation and pulmonary microaspiration: Results of a randomized controlled trial. Crit Care Med 2001; 29:1495-1501.
17. Pugin J., Auckenthaler R., Mili N., et al. Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic blind broncho-alveolar lavage fluid. Am Rev Respir Dis 1991; 143:1121-1129.
18. Luna C.M., Videla A., Mattera J., et al. Blood cultures have limited value in predicting severity of illness and as a diagnostic tool in ventilator-associated pneumonia. Chest 1999; 116:1075-1084.
19. Fagon J.Y., Chastre J., Wolff M., et al. Invasive and noninvasive strategies for management of suspected ventilator-associated pneumonia. A randomized trial. Ann Intern Med 2000; 132:621-630.
20. Cook D., Mandell L. Endotracheal aspiration in the diagnosis of ventilator-associated pneumonia. Chest 2000; 117:195S-197S.
21. Campbell G.D. Blinded invasive diagnostic procedures in ventilator-associated pneumonia. Chest 2000; 117:207S-211S.
22. Shorr A.F., Sherner J.H., Jackson W.L., Kollef M.H. Invasive approaches to diagnosis of ventilator-associated pneumonia: A meta-analysis. Crit Care Med 2005; 33:46-53.
23. Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04). Клин микробиол антимикроб химиотер 2004; 6:306-359
24. Knaus W.A., Draper E.A., Wagner D.P., Zimmerman J.E. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13:818-829.
25. Teasdale C., Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet. 1974; 2:81-83.
26. Kollef M.H., Scherman G., Want S., et al. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest 1999; 115:462-474.
27. Kollef M.H. Inadequate antimicrobial treatment: an important determinant of outcome for hospitalized patients. Clin. Infect. Dis. 2000; 31(Suppl. 4):S131-S138.
28. Alwarez-Lerma F. Modification of empiric antibiotic treatment in patients with pneumonia acquired in Intensive Care Unit: ICU Acquired Pneumonia Study Group. Intensive Care Med 1996; 22:387-394.
29. Iregui M., Ward S., Sherman G., et al. Clinical importance of delays in the initiation of appropriate antibiotic treatment for ventilator-associated pneumonia. Chest. 2002; 122:262-268.
30. Niederman M.S. Therapy of ventilator-associated pneumonia: What more can we do to use less antibiotics? Crit. Care Med. 2004; 32:2344-2345.
31. Cometta A.J., Baumgartner D., Lew D., et al. Prospective randomized comparison of imipenem monotherapy with imipenem plus netilmicin for treatment of severe infections in nonneutropenic patients. Antimicrob Agents Chemother 1994; 38:1309-1313.
32. Paul M., Benuri-Silbiger I., Soares-Weiser K., et al. Beta-lactam monotherapy versus beta-lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and meta-analysis of randomized trials. BMJ 2004; 328(7441):668. doi:10.1136/bmj.38028.520995.63 (published 2 March 2004)
33. Singh N., Rogers P., Atwood C.W., et al. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. Am J Respir Crit Care Med 2000; 162:505-511.
34. Luna C.M., Blanzaco D., Niederman M.S., et al. Resolution of ventilator-associated pneumonia: prospective evaluation of the clinical pulmonary infection score as an early clinical predictor of outcome. Crit. Care Med. 2003; 31:676-682.
35. Dennesen P.J., Van der Ven A.J., Kessels A.G., et al. Resolution of infectious parameters after antimicrobial therapy in patients with ventilator-associated pneumonia. Am. J. Respir. Crit. Care Med 2001; 163:1371-1375.
36. Chastre J., Wolff M., Fagon J.-Y., et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults. A randomized trial. JAMA. 2003; 290:2588-2598.
37. Micek S.T., Ward S., Fraser V.J., et al. A randomized controlled trial of antibiotic discontinuation policy for clinically suspected ventilator-associated pneumonia. Chest. 2004; 125:1791-1799.
38. Hoffken G., Niederman M.S. Nosocomial pneumonia: the importance of a de-escalating strategy for antibiotic treatment of pneumonia in the ICU. Chest. 2002; 122:2183-2196.
39. Rello J., Vidaur L., Sandiumenge A., et al. De-escalation therapy in ventilator-associated pneumonia. Crit Care Med 2004; 32:2183-2190.
40. Ibrahim E.H., Ward S., Sherman G., et al. Experience with a clinical guideline for the treatment of ventilator-associated pneumonia. Crit Care Med 2001; 29:1109-1115.
41. Kollef M.H., Niederman M.S., Leeper K.V., et al. Escalation / de-escalation of initial empiric ventilator-associated pneumonia therapy: interim results from the assessment of local antimicrobial resistance measures study. Chest. 2004; 126(Suppl. 4): 718S.
42. Orozco-Levi M., Torres A., Ferrer M., et al. Semirecumbent position protects from pulmonary aspiration but not completely from gastroesophageal reflux in mechanically ventilated patients. Am J Respir Crit Care Med 1995; 152:1387-1390.
43. Torres A., Serra-Batlles J., Ros E., et al. Pulmonary aspiration of gastric contents in patients receiving mechanical ventilation: the effect of body position. Ann Intern Med 1992; 116:540-543.
44. A Guide to Infection Control in the Hospital. 2nd Ed. Eds: R. Wenzel, T. Brewer, J.-P. Butzler. BC Decker Inc. London, 2002.
45. Koeman M., Van der Ven A.J.A., Hoepelman I.M., et al. Oropharyngeal decontamination with chlorhexidine gluconate-2%, with or without colistin, reduces the incidence of ventilator-associated pneumonia: a randomized double-blind, placebo-controlled, multi center study. 44th ICAAC, 2004, Abstract 3717.
