Методы изучения вирулентных фагов
Подготовка материала
Материалом, из которого выделяют фаг, обычно являются фильтраты, полученные с помощью бактериальных фильтров из объектов внешней среды, органов и выделений человека и животных, культур микроорганизмов и т. д.
Перед фильтрацией исследуемый материал подготавливают следующим образом:
Жидкости (кровь, мочу, воду, смывы с предметов и т. п.) освобождают от крупных частиц с помощью бумажного фильтра или центрифугированием, чтобы они не забили поры бактериального фильтра.
Вязкий материал (гной, кал) эмульгируют в изотоническом растворе натрия хлорида или бульоне, после чего освобождают от крупных частиц, как описано выше.
Плотный материал (кусочки органов, пищи и т. п.) предварительно измельчают - обычно растирают в ступке со стерильным кварцевым песком. Вместо песка можно использовать стерильные кончики пастеровских пипеток или битые покровные стекла. Растертый материал тщательно эмульгируют в изотоническом растворе натрия хлорида или бульоне и освобождают от крупной взвеси.
Подготовленный материал пропускают через бактериальный фильтр, освобождая от посторонней микрофлоры.
Культуры микроорганизмов (известные или изучаемые). В работе с фагом применяют 20-24-часовые культуры, выращенные на агаре, или 2-6-часовые культуры в жидких средах. Чистоту культуры устанавливают в мазках, окрашенных фуксином Пфейффера или по Граму. Из культур, выращенных на скошенном агаре, готовят взвесь. В пробирку с культурой наливают 3-5 мл изотонического раствора натрия хлорида. Вращая пробирку между ладонями, осторожно смывают культуру с поверхности среды так, чтобы не намочить пробку. Взвесь переносят в стерильную пробирку и разводят изотоническим раствором натрия хлорида 1:10 (0,5 мл взвеси в 4,5 мл раствора).
При работе с фагом необходима стерильная посуда (градуированные и пастеровские пипетки, чашки Петри, пробирки, колбы, ступки), термостат, фильтровальное устройство, центрифуга, штативы, прибор для счета колоний.
Внимание! Вся работа с фагом требует соблюдения асептики.
Качественные методы
О наличии фага в том или ином субстрате узнают по лизису чувствительной к нему микробной культуры (тест-культура).
Обнаружение фага на плотных средах. Тест-культуру засевают "газоном" (см. главу 7) на поверхность агара в чашке Петри. Посев подсушивают в термостате 30-40 мин при открытой крышке, после чего на него наносят каплю изучаемого материала. Через несколько минут, когда жидкость впитается, чашки помещают в термостат на 18-20 ч. Если в изучаемом материале есть фаг, произойдет лизис культуры и на месте, куда была нанесена капля, культура или совсем не вырастет (сплошной лизис) или образуются отдельные колонии фага.
Обнаружение фага в жидких средах. В две пробирки с одинаковым количеством бульона вносят по одной капле культуры, микроба, в отношении которого изучают фаг. В одну из них добавляют исследуемый фаг или фильтрат материала, в котором его определяют. Вторая пробирка служит контролем роста культуры. Пробирки помещают в термостат на 12-20 ч. Учет результатов производят только при наличии роста культуры в контроле (помутнение среды). Отсутствие видимого роста или последующее просветление среды в пробирке с исследуемым материалом свидетельствует о присутствии фага. Если содержимое этой пробирки мутное, исследование необходимо дополнить посевом на плотную среду: помутнение могло произойти от роста устойчивой к фагу культуры. Только в том случае, если в посеве на агар фаг не будет обнаружен, можно сделать вывод, что его нет в изучаемом материале.
Количественные методы
Количественные методы имеют большое значение при проведении многих исследований, в том числе и фага. Врачу нужно знать активность фага, чтобы правильно установить его дозу при лечебно-профилактическом применении, исследователю - чтобы выяснить, как изменяется активность фага в эксперименте.
Активность фага выражают понятием титр, различая титр фага в жидкой и на плотной среде.
При исследовании в жидкой среде (по Аппельману) титр фага - это наибольшее его разведение (или наименьшее количество), которое подавляет рост тест-культуры в условиях данного опыта.
На плотной среде (титрование по Грациа) титр фага - количество частиц (корпускул) фага в 1 мл исходного материала.
Титрование фага по Аппельману (в жидкой среде). При титровании фага объем и состав среды, температура, аэрация, количество микробов, пробирки, в которых проводят титрование (диаметр, конфигурация дна, толщина стекла), должны быть одинаковыми. Изменяется только количество фага.
Все компоненты, участвующие в биологических опытах, подлежат обязательному контролю на правильность их работы.
При титровании фага ставят контроль фага и бульона на стерильность, контроль культуры - на ее жизнеспособность.
Постановка опыта. 1. В 12 стерильных пробирок наливают по 4,5 мл стерильного бульона. Уровень жидкости во всех пробирках должен быть одинаковым. Если это не так, значит допущена ошибка. В этом случае нестандартную пробирку заменяют новой и заново наполняют бульоном. При разливе бульона пользуются пипетками вместимостью 5-10 мл.
2. Пробирки ставят в штатив и нумеруют от 1 до 10, на одной из оставшихся пробирок пишут "КК" (контроль культуры), на другой - "КФ" (контроль фага). Все пробирки, в которых проводят опыт, должны быть надписаны.
3. В десяти пробирках готовят последовательные десятикратные разведения фага от 10-1 до 10-10 (табл. 9). В 1-ю пробирку вносят 0,5 мл фага. Такое же количество вносят в пробирку контроля фага. Сменив пипетку, новой пипеткой тщательно перемешивают содержимое 1-й пробирки и переносят 0,5 мл его во 2-ю пробирку; 0,5 мл содержимого 2-й пробирки переносят в 3-ю и так далее до 10-й пробирки, меняя каждый раз пипетки. Перемешав содержимое 10-й пробирки, 0,5 мл жидкости из нее выливают в дезинфицирующий раствор. Также поступают с содержимым пробирки контроля фага. Для разведения фага пользуются пипетками вместимостью 1-2 мл. Проверяют уровень жидкости в пробирках. Он должен быть одинаковым.
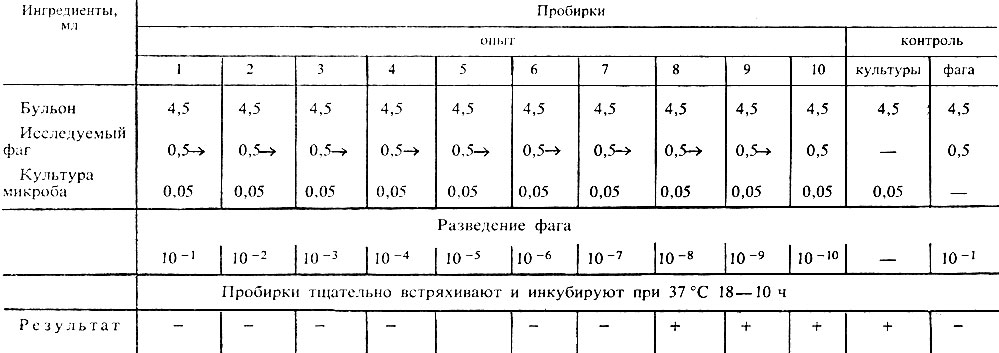
Таблица 9. Схема титрования фага по Аппельману
Условные обозначения: + рост культуры, - отсутствие роста культуры.
Примечание. Стрелки указывают перенос фага из пробирки в пробирку. Из пробирки 10 и из пробирки контроля фага 0,5 мл выливают в дезинфецирующий раствор.
4. Во все пробирки, кроме пробирки контроля фага, вносят по 1 капле (0,05 мл) взвеси тест-культуры. Пробирки встряхивают. Во всех пробирках, кроме пробирки контроля фага, должна появиться слегка заметная муть. Если этого не происходит, все операции с нестандартной пробиркой повторяют вновь.
5. Пробирки помещают в термостат на 18-20 ч, после чего учитывают результат титрования. Учет результатов обязательно начинают с контролей.
При правильной постановке опыта в контроле культуры должно быть размножение бактерий - содержимое пробирки становится мутным. Этот контроль позволяет сделать вывод, что взятая в опыт культура жизнеспособна и что питательная среда обеспечивает ее развитие в данных условиях опыта. Значит, если в пробирках с фагом культура не выросла, на нее подействовал фаг.
Жидкость в пробирке с контролем фага должна остаться прозрачной. Этот контроль позволяет сделать вывод, что посуда, бульон и фаг стерильны.
При правильных результатах в контролях регистрируют характер изменений в первых десяти пробирках. Рост культуры в пробирках "опытного" ряда говорит об отсутствии или недостаточном количестве в них фага. Устанавливают титр фага, т. е. его наибольшее разведение, в котором произошел лизис культуры (содержимое пробирки прозрачно). Обозначают титр степенью разведения фага с обратным знаком, что соответствует порядковому номеру пробирки. Например, если культура не растет в первых семи пробирках, титр фага равен 10-7 (см. табл. 9).
Титрование фага по Грация (на плотной среде) методом агаровых слоев позволяет определить количество частиц фага в титруемом материале. Метод основан на том, что каждая частица фага дает зону просветления (лизиса) на чашке с газоном чувствительного к нему микроба, т. е. образует отдельную колонию.
Постановка опыта. Чашки с 20-25 мл МПА покрывают стерильной фильтровальной бумагой и подсушивают в термостате или под бактерицидной лампой (расстояние от лампы не более 2 м). Титруемый фаг разводят от 10-1 до 10-10 (как в предыдущем опыте) и по 1 мл переносят в другие пронумерованные пробирки (соответственно из 1-й в 1-ю и так далее до 10-й), в которые заранее наливают по 2,5 мл 0,7% МПА, расплавленного и остуженного до 45° С. В каждую из этих пробирок добавляют по 0,1 мл тест-культуры. Содержимое пробирок быстро перемешивают (не дать застыть агару) и выливают на поверхность среды в чашки Петри с номерами, соответствующими номерам пробирок. Через 30 мин чашки ставят в термостат.
Учет результатов проводят через 18-20 ч. При большой концентрации фага (в первых чашках) произойдет сплошной лизис культуры. В тех разведениях фага, в которых находилось небольшое количество частиц фага, появятся изолированные колонии, которые подсчитывают. Чтобы не ошибиться в счете, каждую учтенную колонию помечают со стороны дна чашки. Аппарат для счета колоний намного облегчает работу (см. рис. 54). Чтобы установить количество частиц фага в 1 мл фаголизата, пользуются формулой: n = y×x, где n - искомое число; y - количество выросших на чашке колоний фага; x - разведение фага в чашке, в которой подсчитаны колонии.
Например, если в чашке с разведением фага 10-8 (1:108) выросло 25 колоний, то в 1 мл исходной жидкости содержится 25×108 или 2,5×109частиц фага.
Более точные результаты получают, если определяют количество частиц фага в исходной жидкости по нескольким разведениям и вычисляют среднее арифметическое. Например, при разведении фага 10-6 выросло 320 колоний, следовательно, в 1 мл исходной жидкости было 320×10 или 3,2×108 частиц фага. При разведении фага 10-7 выросло 42 колонии, следовательно, в исходной жидкости было 4,2×108/мл частиц фага. При разведении фага 10-8 выросло 5 колоний, следовательно, в исходной жидкости было 5×108/мл частиц фага. Сложив величины, полученные при этих подсчетах и разделив сумму на 3 (количество проведенных подсчетов), устанавливают число частиц фага в 1 мл титруемого препарата. В нашем примере оно равно 4,1×108.
Подсчитывать колонии лучше всего на чашках, где выросло не меньше 5 и не больше 50 колоний. В противном случае страдает точность подсчёта. Если на чашке много колоний, чашку можно разделить на несколько секторов, сосчитать колонии на одном из них и полученную цифру умножить на количество секторов.
Как правило, все биологические исследования проводят в трех параллельных опытах. В данном примере каждое разведение фага одновременно титруют трижды.
Методы выделения фагов
Прямой метод. Фаг получают и изучают непосредственно в фильтратах исследуемого материала. О наличии и активности фага узнают по лизису чувствительной к нему культуры.
Как правило, прямой метод не дает убедительных результатов из-за малого количества содержащегося в фильтрате фага. Для повышения его количества используют методы обогащения.
Метод обогащения. Подготовленный фильтрат вносят в 2-3-часовую бульонную культуру соответствующих микроорганизмов. Посев инкубируют в термостате. Фаг размножается в клетках культуры и титр его значительно увеличивается. После этого бульон фильтруют и в фильтрате определяют свойства и активность фага.
